資料請求番号:TS74 TS84

CONTENTS
ルビーの赤色の秘密
ルビーというのはダイヤモンドに次ぐ硬度を誇る宝石の一種で、7月の誕生石にもなっていますね。ルビーは石言葉として「熱情、情熱、純愛」称されるように、美しい赤色の宝石です。
今回は「ルビーがなぜ赤色をしているのか」について、ルビーの構造やルビーを構成する原子の電子配置から考えてみたいと思います。
ルビーの基本構造 コランダム
ルビーはコランダム(鋼玉)と呼ばれる鉱物の変種です。コランダムにクロムと呼ばれる不純物が入るとあの美しい赤色を呈するようになるのです。まずはコランダムの構造について知ることから始めましょう。
コランダムの成分”アルミナ”
コランダムの成分はアルミナ(酸化アルミニウムAl2O3)です。アルミナは水和物(水分子がくっついた状態)や色々な不純物がくっついた状態であるボーキサイトを自然から採取して作られます。
アルミナには二種類の結晶構造があり、スピネル型とコランダム型があります。
名前が少しややこしいですが
・コランダム→鉱物の名前
・アルミナ→物質の名前
・コランダム型→結晶構造の名前 と整理しましょう。
コランダム型のアルミナの構造
ルビーはコランダム型のアルミナを基本とします。コランダム型のアルミナの構造を示します。青色の玉が酸素、灰色の玉がアルミニウムです。酸素の半径は(正確にはイオン半径)は126pm(1pm = 10-12 m, 1nmの1000分の1), アルミニウムの半径は68pmであり、AlとOの位置は少し歪んでいます。(原子の大きさがちょうどよい大きさじゃないので、規則的な構造から少し歪んでいるというイメージ)
しかし、ある程度の規則はあって、3つの酸素原子が作る窪みにアルミニウム原子が入る形をしています。
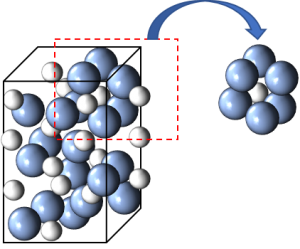

この構造は「6配位八面体」に分類することができます。この構造を図形的に描くと、こんな感じになります。(大きさの概念は無視して、構造のわかりやすさを重視しています。)

アルミナ中の不純物
コランダム型にクロム原子が入るとルビーになる
基本構造が分かったところで、いよいよルビーの話に入ります。ルビーというのは、上に示したコランダム型の構造にクロムと呼ばれる原子が不純物として3%ほど含まれたものを言います。つまり、ルビーの中にはこのような構造が含まれます。


6つの酸素にクロムが囲まれた状態です。この構造がルビーの赤色の正体なのです。構造と色を結び付けるには「原子の電子状態」というものを知る必要があります。
原子の電子状態
6配位8面体の中心原子がアルミニウムの時は発色しないのに、中心原子がクロムに置き換わると赤色になります。この謎を解くヒントは二つの原子の電子状態の違いです。
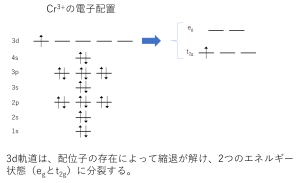
左にアルミニウムの、右にクロムの電子状態を示します。結晶になっているときはイオンの状態で存在しますから、それぞれのイオン(Al3+とCr3+)の電子状態を示します。横線が電子軌道で、その左に書いてある「1s, 2s・・・」は軌道の名前です。矢印は電子を表していて、矢印の向きは「スピン」と呼ばれる電子の状態を表しています。
注)電子軌道というのは、電子が存在する可能性のある範囲のことを言い、スピンというのは電子の自転の状態を表します。詳しい理論は今回はおいておき、今回はアルミニウムとクロムの違いのみに着目したいと思います。

アルミニウムには3dの軌道に電子が入っていないのに対し、クロムには3dの軌道に電子が入っています。ここがポイントになります。
ルビーの赤色の正体
3d軌道の縮退の解除
3d軌道というのは普段はエネルギーが等しい5つの軌道なのですが(この状態を縮退と呼びます)。周囲に原子(今回は酸素,このような原子を配位子と言います。)がやってくると、配位子の軌道との相互作用でこの縮退が解け、2種類のエネルギーの軌道に分裂します。
3d軌道内の電子遷移
3d軌道が二種類のエネルギーに分裂したら、そのエネルギーギャップ(t2gとegの差)を乗り越えて、t2gに存在する電子がegへ移動することがあります。(これを一言で電子が遷移する、あるいは励起するという言い方をします。)
t2gからegのへ電子が遷移するためには、外部からエネルギーが必要です。これが青~緑色の光に相当するエネルギーです。(光の色と光のエネルギーの関係についてはこちら)

私たちの身の回りにある光(太陽光や蛍光灯の光)というのは、色々な波長の光が混じってできた白色光です。このうち、青~緑色の光がクロムの3d軌道に含まれるt2gの状態にある電子がegのへ励起に利用されます。
こうして残った色が赤色であり、ルビーが赤色に見えるのです。

まとめ
ルビーが赤色を呈しているのは「ルビーに含まれるクロムが赤色以外の可視光線を吸収するから」なのです。
今回説明したことを専門用語を遠慮なく利用して説明すれば「コランダム中にクロムが3%ほど含まれることによって、クロムのd軌道と配位子の軌道の相互作用によって配位子場が作られ、d軌道の縮退が解けたために、可視光の青色~緑色の補色である赤色が発色された」と言えます。
物質が吸収しない可視光線の光が私たちの目に見える色なのです。これは葉っぱが緑色である原理と同じなのです。
 らい・ぶらり
らい・ぶらり

コメントを残す