資料請求番号:TS83
スポンサーリンク原子軌道から分子軌道を求める
以前、こちらのページでシュレディンガーの波動方程式から出発して、波動関数を求め、原子の電子軌道(s軌道、p軌道、d軌道)を描画しました。
[blogcard url=”http://shimaphoto03.com/science/sch-equ/”]
このページでは原子一つにおける電子軌道を求めたのですが、この世の物質の多くは酸素、窒素など分子の状態で存在しています。そのため、分子の状態になったら電子軌道はどうなるのか?というのは量子化学的に興味のあるテーマです。
今回は、分子軌道計算の入門編として、化学の学生が勉強するであろう、単純ヒュッケル法による分子軌道計算をやっていきたいと思います。
この単純ヒュッケル法というのは、化学を専門とする学生が物理化学あるいは量子化学という講義名でよく出てくる理論です。
この理論は比較的難しく、永年方程式・行列式の立て方は分かったものの、何のために何を求めているのかが分からない学生も多いのではないか?(自分もそういう学生でした)と思い、この記事を書きました。
また、永年方程式を出すまでの偏微分計算や、係数を求める時の計算にはちょっとした数学的テクニックが必要になります。
ところが、そういった計算テクニックはほとんどの教科書には書いておらず、計算過程で泥沼にはまる学生もいるのではないか?(やはり自分もそういう学生でした)と思い、計算過程も詳しく書いて解説しました。
従って、単純ヒュッケル法に慣れている人にはくどい内容になるかと思いますが、ご容赦ください。
取り扱う物質の設定と求めるもの
π電子共役系分子
分子軌道計算というのは極めて複雑でそのほとんどが紙の上では解けない、すなわち、様々な近似を置いてコンピュータを使用して解いています。その中で、学生の常識的な試験時間で試験用紙の上で解くことができるほど簡単なものが、π電子共役系分子の単純ヒュッケル法による分子軌道計算なのです。

π電子共役系分子と言われてもよく分からないわよ。そこから説明して欲しいな・・・。

エチレン、ブタジエン、ヘキサトリエンなんかがπ電子共役系分子だ。ベンゼンも含まれるったいね。

あの、二重結合-単結合が繰り返しになってるヤツ?

まぁ、そうやな。こういう分子って言うのは、sp2混成軌道を持っている。
まず、炭素の電子配置ってのがこんな感じだろ?


そして、炭素2つでエチレンを構成する時には2sにある電子がp軌道に昇位してこんな電子配置になる。
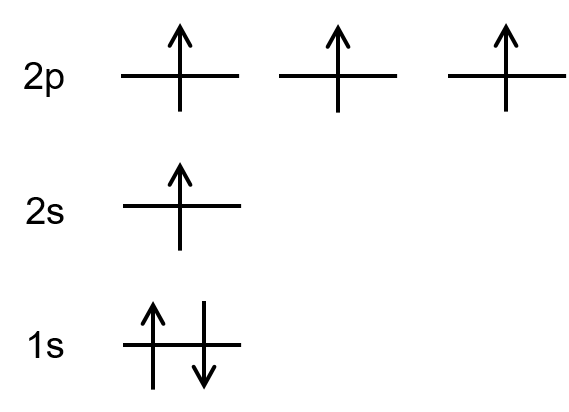

この状態で1個のs軌道と2個のp軌道が混成してsp2混成軌道を作る。この時、一個p軌道が余るよな。


エチレンの場合、sp2混成軌道にそれぞれ水素原子2つと炭素原子1つがσ結合をする。そして、それぞれの炭素が持つ余ったp軌道同士でπ結合をする。
sp2混成軌道に対して垂直なp軌道が連なってるのをπ電子共役系という。簡単にいうとそんな感じたい。
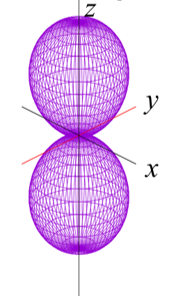

これがp軌道の形。炭素原子にあるこの軌道が連なって相互作用をする。
単純ヒュッケル法で何がわかるか?

それで、今回は、何をどうするの?

何を求めるのか?という疑問はとても大事やな。単に教授の板書通りの計算をして単位を取るのもいいが、
求めるモノはなんなのか?そして、その具体的イメージというのがあったほうが理解がしやすくなる。

このp軌道は炭素の数だけ連なっているんだが、分子になった時、p軌道同士が相互作用するので、p軌道のエネルギーや形というのは、原子の状態におけるp軌道とは違うモノになっている。今回は、それを求めようということ。

前回はシュレディンガーの波動方程式から球面調和関数を求めて、そこからs、p、dの軌道の形を出したけど、これはあくまで原子の状態になっているときの形状、エネルギー準位なのであって、分子になるとこれらが変わってくるから、それを求めよう。ということなのね?

そういうこと!とりあえず、一番簡単なπ電子共役系分子であるエチレンを対象にp軌道の形状とエネルギー準位を求めてみようぜってことたい。
単純ヒュッケル法のエチレンへの適用
分子軌道は原子軌道の線型結合
それでは、エチレンの分子軌道を計算します。今回の軌道計算に考慮する軌道はsp2混成軌道に垂直なp軌道のみです。この2つのp軌道が分子になったとき、どのような振る舞いをするのかを求めます。
まず、エチレンの2つの炭素にナンバリングをします。


ここから大事なポイント。分子の軌道関数はその分子を構成する原子の軌道関数の線型結合で表現できるということ。
![]() ・・・①
・・・①

c1, c2がそれぞれ定数で、φ1、φ2がそれぞれの原子の軌道関数なのね。

その通り。φ1、φ2はそれぞれ、この形をしている。


分子になった場合、これがどうなるか?って言うのが今回の問題だ。

ψが分子軌道関数なワケで、今、分かっていない未知数ってのがc1, c2なんやな。これらを求めれば、ψがどんな関数なのかわかるようになるたい。
分子軌道のエネルギーを求める
永年方程式の導出

まずは、分子軌道のエネルギーを求めよう。シュレディンガーの波動方程式は②式で、ハミルトニアン演算子を記号Hヤマで表す。
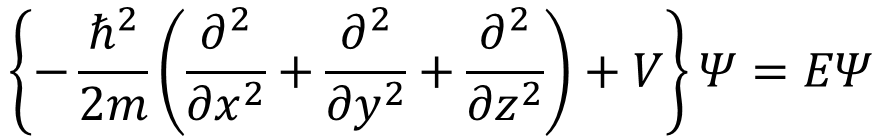 ・・・②
・・・②
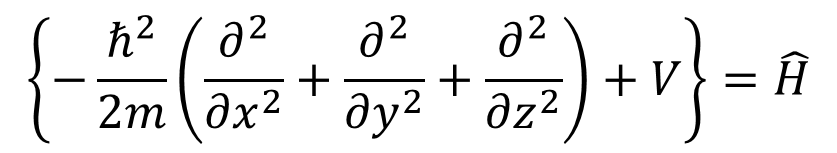

え?Hヤマってこの、Hハットのこと?面白い言い方するのね。

え?俺、Hヤマが普通だと思ってたけんね。色々呼び方あると、あれだよな~。誤解を生みやすいよな~。

そしたら、シュレディンガーの波動方程式はこんな形に簡略化できる。
![]()

両辺にψをかけて積分する。Eは単なる数に過ぎないから積分記号から外れるが、Hヤマはψに作用する演算子なわけだから、その記号だけでは意味をなさず、積分記号から外れないことに注意だ。
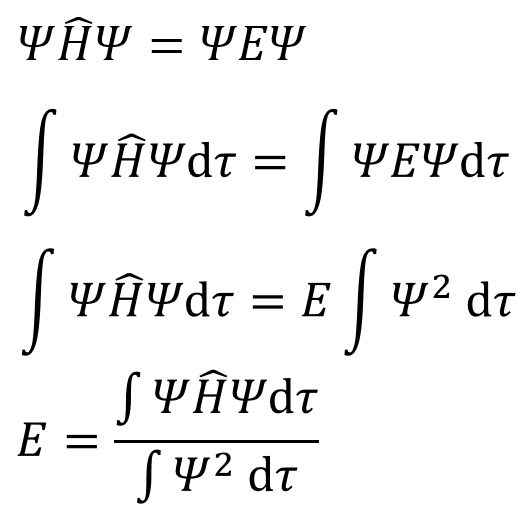 ・・・③
・・・③

ψは元々原子軌道の線型結合で、つまり①式なワケやから、代入してこの形にする。
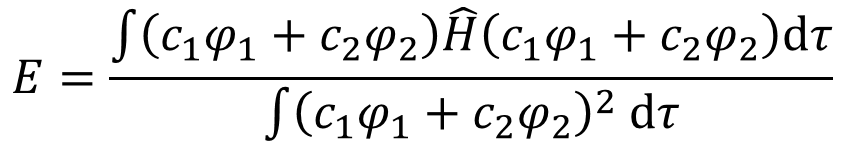 ・・・④
・・・④

そして、これを展開する。Hヤマは演算子でc1, c2はただの数であることを意識して式変形していこう。
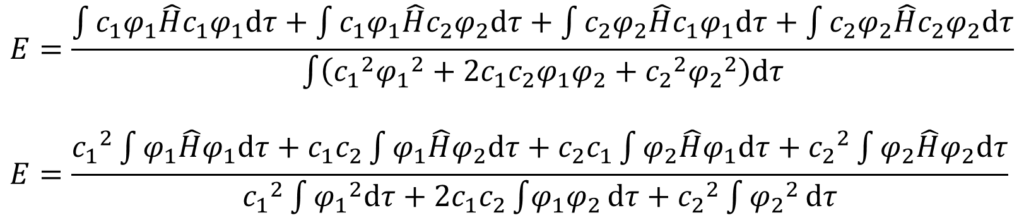 ・・・⑤
・・・⑤

うあ・・・複雑になってきた・・・・。

せやな。じゃあ、簡単にするために、こういう文字を定義しよう。これらの文字、数値の意味は後で説明する。
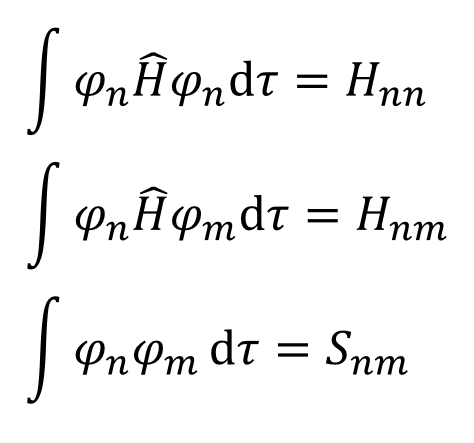 ・・・⑥
・・・⑥

これを⑤式に代入して置き換えると、こうなる。
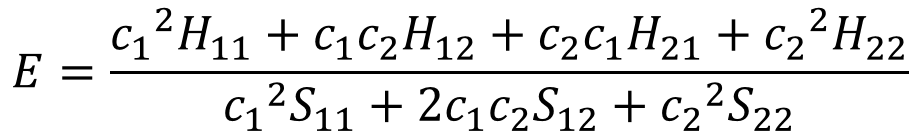 ・・・⑦
・・・⑦

それで、H12=H21と置ける。この理由も後で説明するたい。
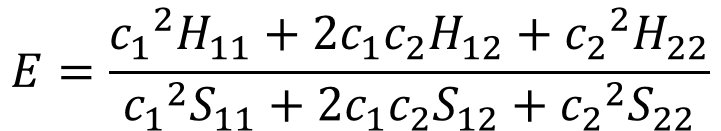 ・・・⑧
・・・⑧

これで、Eの式が出てきたようだけど、これでいいの?

ダメだ。これじゃあc1, c2が最適化できてない。最適なc1, c2を決めてやらないといけんね。

これ、どうやって、最適なc1, c2を決めるの?

Eはc1, c2の関数として、c1, c2が極小になったときが最適なc1, c2やという条件を与えてあげると。エネルギーは何もなければ基本的に最小の値を取るのが普通やろ?

関数Eの極小値を与えるc1, c2を求めるってことは・・・。

え~、この関数をc1, c2で偏微分するの~??めんどくさい~。。。

その通り。偏微分するんだが、ここで思い出してほしい高校数学の公式がある。
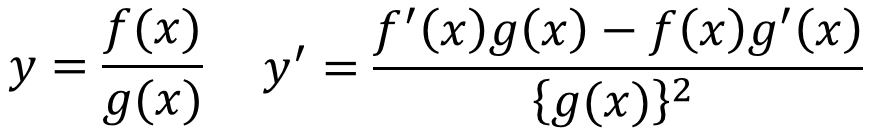

分数の微分の公式じゃない。これ分かってたところで計算が簡単にならないっていうか・・・、あの関数⑧をこの公式に当てはめるからめんどくさいんだら?

確かにそうなんやが、こんな風に関数を置いて、なるべく展開せずにやると簡単に偏微分できるたい。
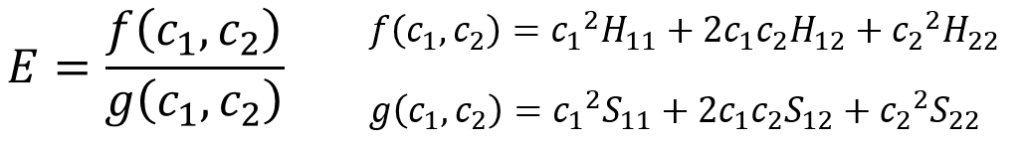

これを高校数学で習う分数の微分の公式に当てはめると・・・
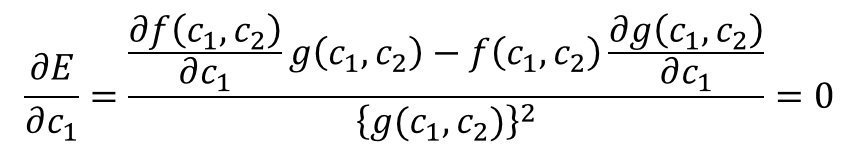

あっ!、gが丸ごと消去できたり、f/gが出てくるけど、これEだね。

そう!計算の続きを書いてくぜ。
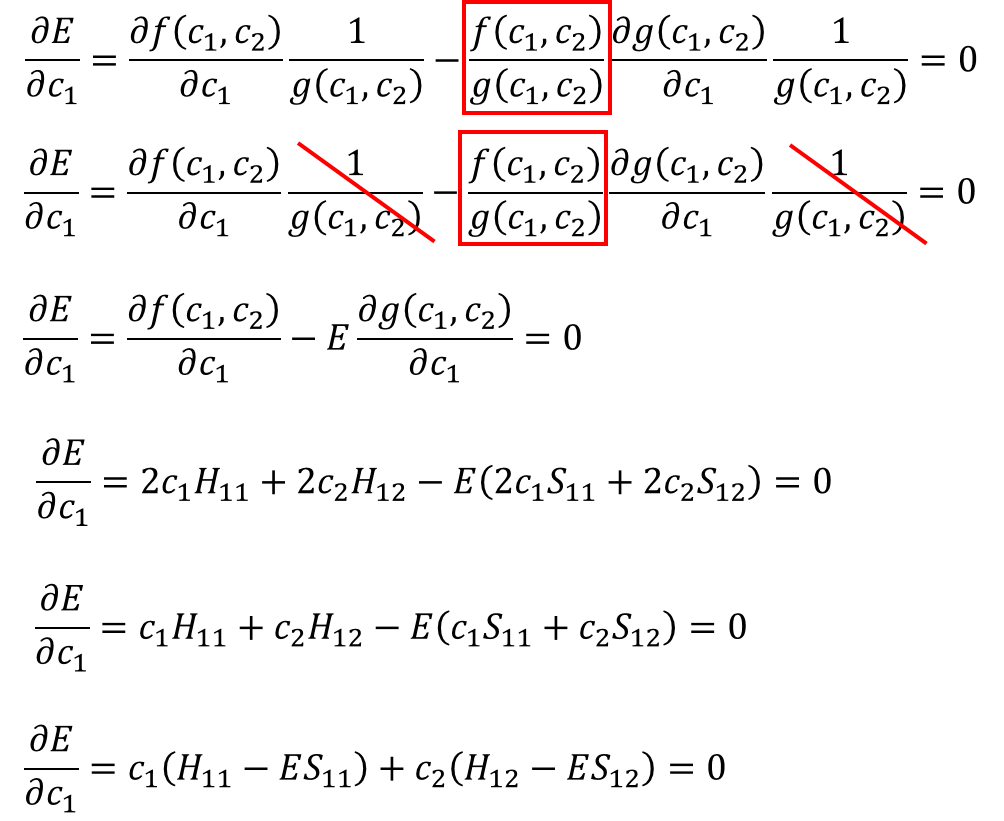 ・・・⑨
・・・⑨

同様にc2でも偏微分して
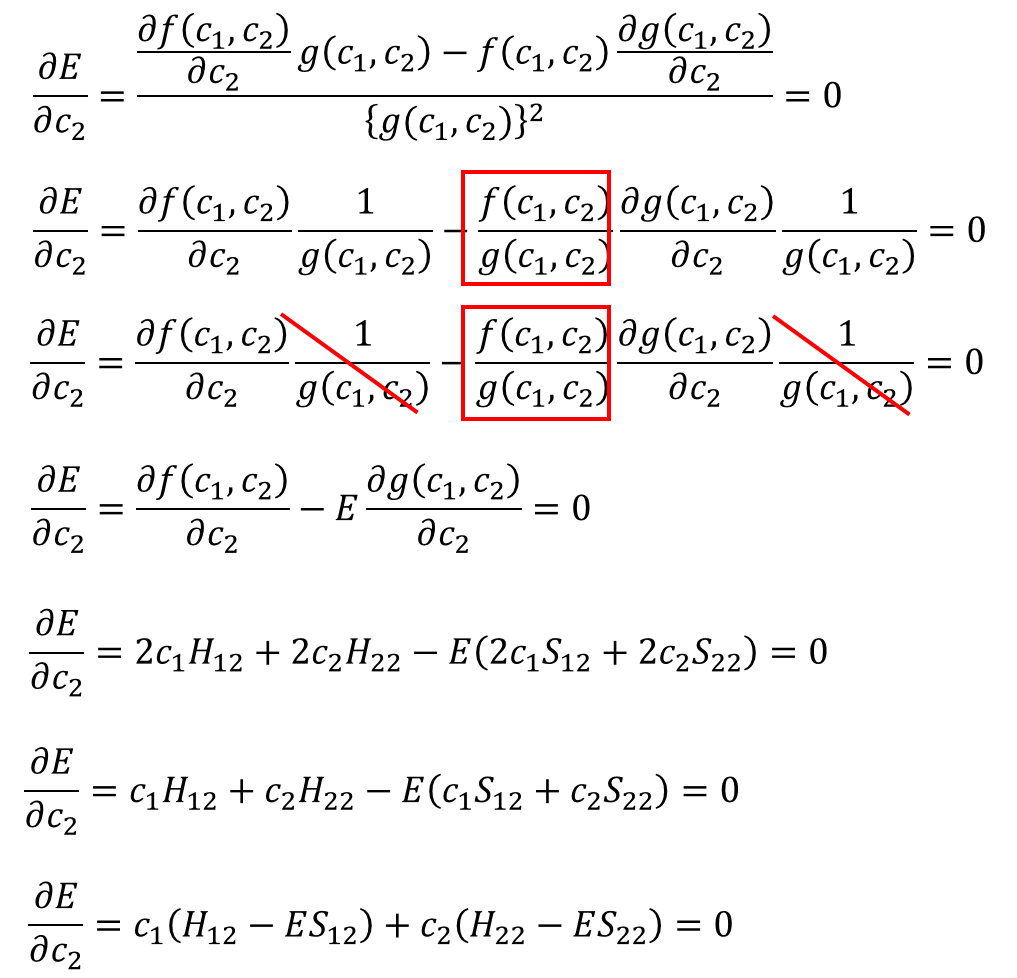 ・・・⑩
・・・⑩

⑨と⑩の結果から、この2つの方程式ができるな。
![]() ・・・⑪
・・・⑪
![]() ・・・⑫
・・・⑫

⑩式から⑫式でしれっとH12とH21が入れ替わっているけど、これらは同じ数値だからいいのね。

結局、HとかSってなんなの?

これはクーロン積分・共鳴積分・重なり積分というものなんだ。
クーロン積分・共鳴積分・重なり積分

H11とか、H22とか、前の数字と後ろの数字が同じになっているHはクーロン積分という。
クーロン積分は分子を構成する原子自身のエネルギーを表す。原子1つで存在した場合のエネルギー量だな。αで表現する。

隣のp軌道との相互作用を受けなかった場合、エネルギーはそのままクーロン積分の値になるってことね。

その通り!そして、H12とか、H21とか前の数字と後ろの数字が違うHは共鳴積分という。
これは隣接原子間の相互作用を表すエネルギーだ。原子1から見たときの原子2からの影響、そしてその逆、原子2から見たときの原子1からの影響って同じだろ?
だからH12 = H21なんだ。これはβで表現する。

なるほど・・・。

そして、Sは重なり積分という。注目している軌道との重なりの程度を表す。S11は同じ軌道、つまり、完全に重なっていると考えるから値は1、そして今回、違う軌道との間では重なりはないと仮定するから、S12のように、前の数字と後ろの数字が違うSは0とする。

以上、3つの積分をまとめたぜ。そして、クーロン積分・共鳴積分・重なり積分のイメージを描いてみた。
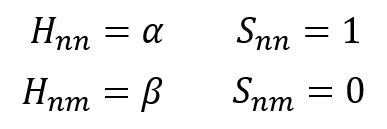 ・・・⑬
・・・⑬

永年行列式を解く

さっきの⑪式、⑫式を行列形式で書いてみた。
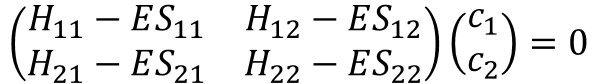 ・・・⑭
・・・⑭

ここで、この連立方程式が零解、つまりc1= 0, c2 = 0 にならないような解を持つとき、
こんな固有方程式を満たす。これは定理だな。この行列式を解いて、エネルギー値を求めるんだ。
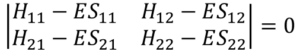 ・・・⑮
・・・⑮

ここでさっきのクーロン積分・共鳴積分・重なり積分の定義、⑬式を当てはめる。
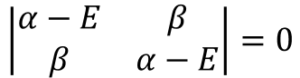 ・・・⑯
・・・⑯

だいぶ簡単になったわね。

もっと簡単にできるぜ。この行列式全体をβで割って、α-E/βをxと置くんだ。
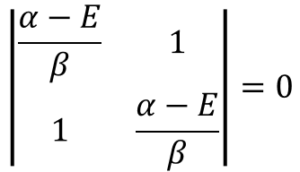
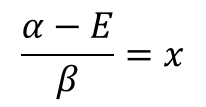
![]() ・・・⑰
・・・⑰

そしたらもう、あとの計算は簡単だ。
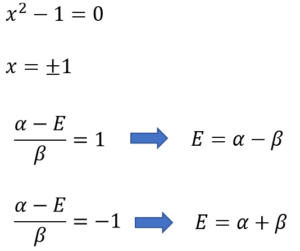 ・・・⑱
・・・⑱

E = α-βとE = α+βがエネルギー値の答えなの?これ、どう解釈すればいいの?

エネルギーαを持つp軌道中のπ電子は、エチレン分子になると、エネルギーがα-βとα+βになるってことだ。
図に示すとこんな感じ。
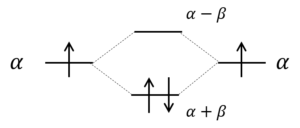

これ、α+βの方が低いエネルギーなのね。

そうだ。βは負の値やからな。

この図から何がわかるの?

もともと、それぞれαだけエネルギーを持っていた2つの炭素原子のp軌道中のπ電子は、エチレン分子になるとE = α + βのエネルギーの軌道に収容される。すなわち、2つの電子のエネルギーは2βだけ下がる。これを共鳴安定化というんだ。

あ~、なるほど。p軌道中の電子が自由に移動できることで安定化するってのは、なんかパンキョーの化学でやった気がするけど、これを定量的に評価すると、エチレンの場合、2βになるのね。
分子軌道関数を求める

さて、これまで分子軌道のエネルギーを求めてきたが、軌道関数はまだ求められていない。c1, c2を求めないといけないな。

どうやって求めるの?

規格化条件というのを使う。

規格化条件・・・えっと・・・一次元井戸型ポテンシャルで出たような気がする。
電子の確率分布、つまり軌道関数を全領域にわたって積分すれば1になるってヤツだら?

そう。それや!⑪式、⑫式から変形していくたい。まずは、クーロン積分・共鳴積分・重なり積分を使って・・・
![]()
![]()
![]()
![]()

そして、Eがα+βだった場合、これを代入して
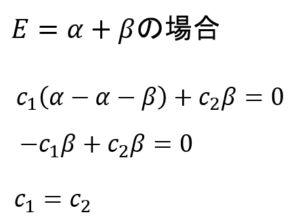 ・・・⑲
・・・⑲

c1とc2は同じ値だったのね。

ああ。エチレンの場合のみ、たまたまそうなっただけたい。それで、一番最初の線形結合の式、①式にこの情報を適用する。
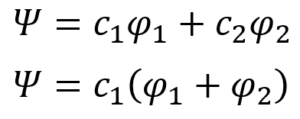 ・・・⑳
・・・⑳

ここで、規格化条件の登場だ。途中で重なり積分が登場するから、さっきの⑬式で表した重なり積分の仮定を思い出しつつ変形していくと・・・
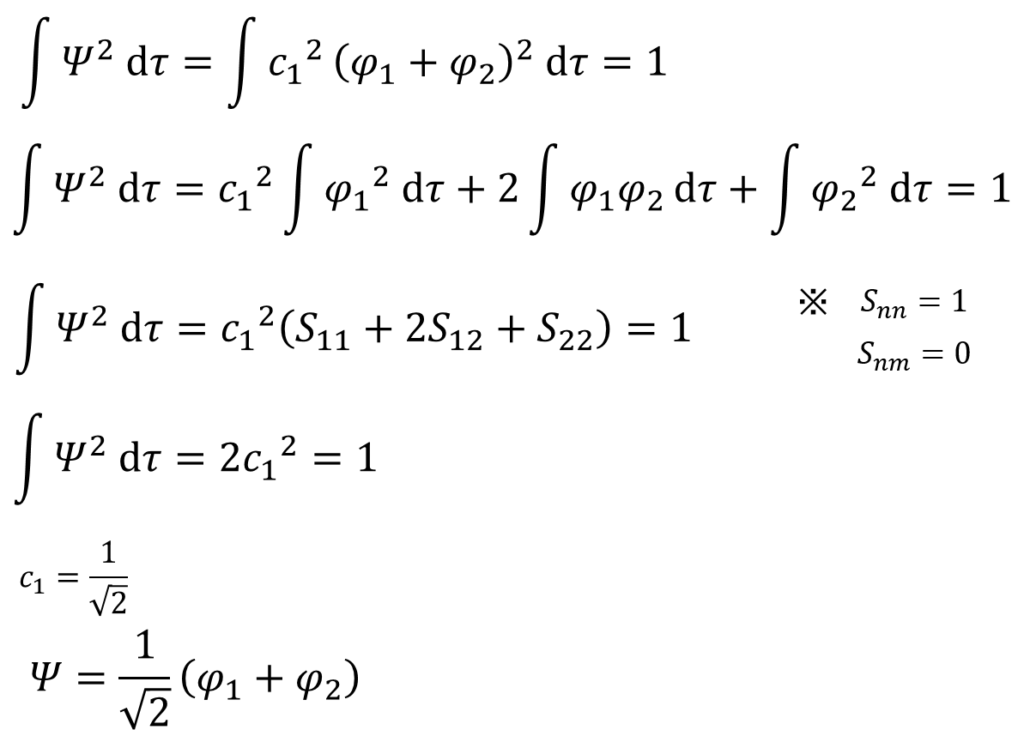 ・・・㉒
・・・㉒

え?この結果って何を表すの??

まぁ、待て。E = α-βの場合もやってからそれは考えようぜ。
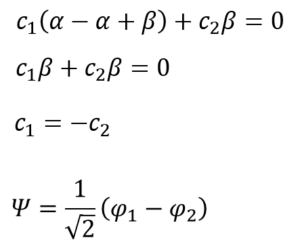 ・・・㉓
・・・㉓

この2つのψを図示するとこうなる。
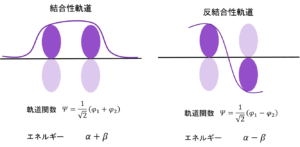

これが、エチレンの分子軌道の形?

そうだ。濃い紫と薄い紫があるだろ?φがプラスの時は上に、マイナスのときは下に電子がある。さらに、原子の状態に比べて軌道の大きさが1/√2、すなわち0.707倍、ちょっと小さくなっているということもわかる。

そして、一番大切なところ。電子のあるところが上2つでそろってると安定なんだ。非局在化できるからな。電子は基本自由に動き回れるほど安定。それに対して、電子のあるところがノードをまたがるとエネルギーは高くなる。それぞれの電子がそれぞれの軌道の中に留まるしかないからだ。

ノードって何?

これは節ともいうが、p軌道って、上半分と下半分の接点では電子が存在することができんけん。それをノードという。

ノードがあると、電子は同じ軌道に閉じ込められざるを得ないから、エネルギーが高くなってしまうってこと?

そう!その通り!
単純ヒュッケル法のブタジエンへの適用
分子軌道のエネルギーを求める
次に、ブタジエンの分子軌道を求めてみましょう。ブタジエンはこのような形をしています。
![]()
炭素4つで構成されるブタジエンの分子軌道関数は
![]()
となります。

シュレディンガーの波動方程式から計算してもええけど、めんどくさいから、永年方程式から始めるぜ。
炭素4つのブタジエンの場合、方程式の行列のサイズは4×4になる。
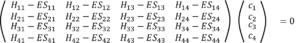 ・・・㉔
・・・㉔

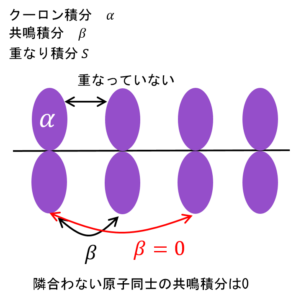
そして、クーロン積分・共鳴積分・重なり積分の定義を適用するんやが、ここで注意。
H13やH14など、隣合わない原子のp軌道からは何の影響も受けないと考える。
よって、これらの値はゼロたい。

そしたら、永年方程式と永年行列式はこんな形になって・・・・
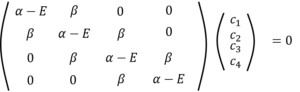 ・・・㉕
・・・㉕
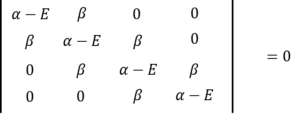 ・・・㉖
・・・㉖

これもβで割ってα-E/β = xと置けば、こんな簡単な行列式になる。
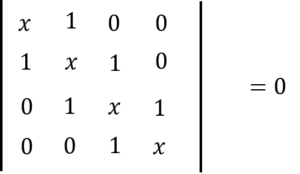 ・・・㉗
・・・㉗

これ、プログラム使わないで紙の上で解く場合、どうするんだっけ?

オマエが実装しているアルゴリズムと同じことを紙の上でやるだけだ。
まず、1行目と2行目をひっくり返して、このときにマイナスが出るが、イコール0なので、関係ない。
そして、1行目に-xをかけたものを2行目に加える。そしたら、(1,2)成分がゼロになるんで、行列式を切り出すことができる。
これで3×3の行列式になったんで、あとはサラスの方法を使えばいいだろう。
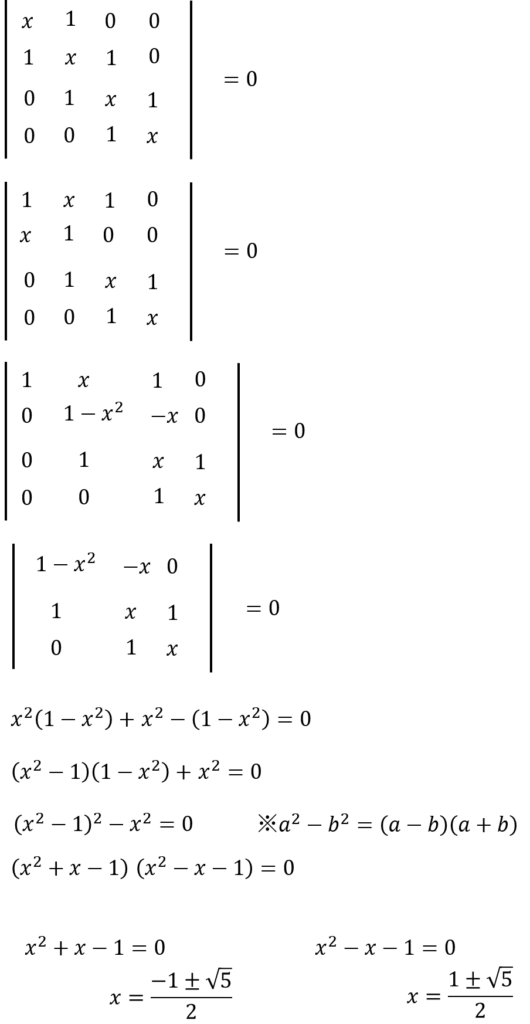 ・・・㉘
・・・㉘

おおっ!できた~

これで4つの解で出たことになる。それぞれのエネルギーを求めて、エネルギー準位図を描くとこうなる。
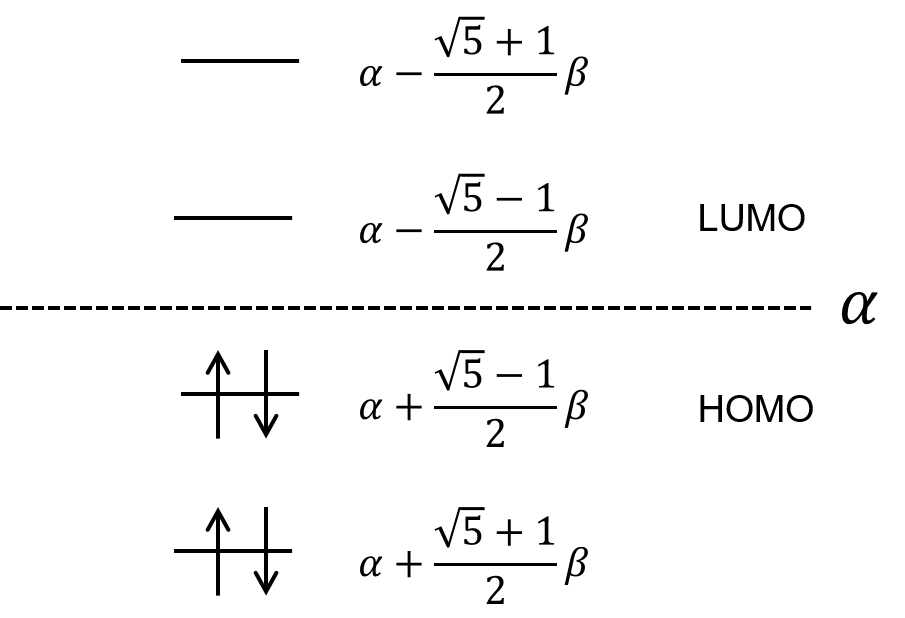

この、HOMOとLUMOってなに?

HOMOはHighest Occupied Molecular Orbital, LUMOは Lowest Unoccupied Molecular Orbitalの略だ。電子によって占有された分子軌道の内、最高の準位をHOMO, 電子に占有されていない分子軌道の内、最低の準位をLUMOと呼ぶ。このHOMO-LUMO間のエネルギーギャップが、その物質が吸う光のエネルギーだ。

このギャップが大きいほど、高いエネルギー、つまり短い波長の光を吸収して、ギャップが小さいほど、低いエネルギー、つまり長い波長の光を吸収するということなのね。
分子軌道関数を求める
次に、c1, c2, c3, c4, の係数を決定し、ブタジエンの分子軌道関数を求めます。

分子軌道関数は、永年方程式にエネルギー値を代入して求めるんやったな。㉕式からこの4つの方程式が得られる。この方程式を連立させて係数を求めていくぞ。
![]() ・・・㉙
・・・㉙
![]() ・・・㉚
・・・㉚
![]() ・・・㉛
・・・㉛
![]() ・・・㉜
・・・㉜

E = α+(√5+1)β/2を代入して、c2,c3,c4をc1で表現して規格化条件を使ってc1を求める。
c2,c3,c4をc1で表現
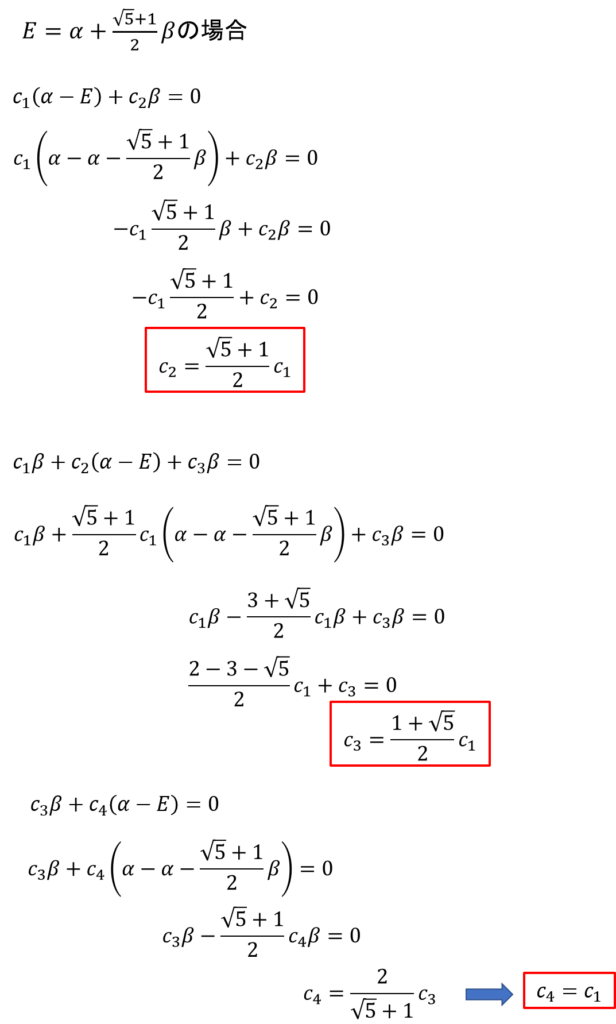 ・・・㉝
・・・㉝
規格化条件を使用して係数c1を決定。
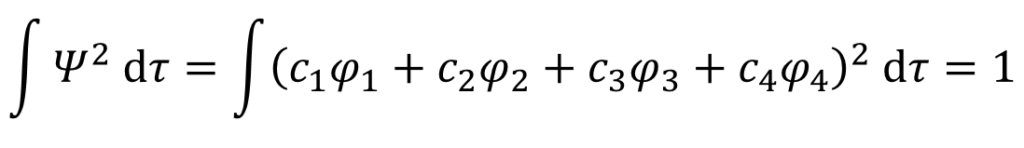

うあ・・・。4つの項の2乗の計算が出てきちゃったよ・・・大変そう・・・。

そんなことないぜ。今回の重なり積分の仮定を思い出してみろ。
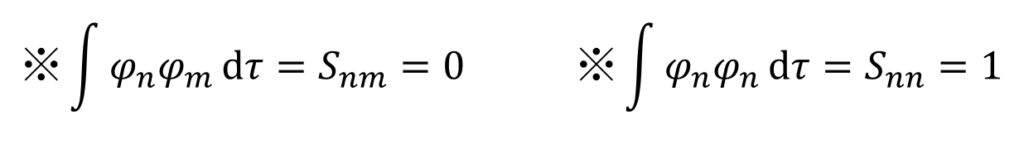

あ、これ、c1φ1c2φ2みたいな、異なる下付き数字の掛け算はゼロになるから、同じ下付き数字の二乗だけが残るんだ!
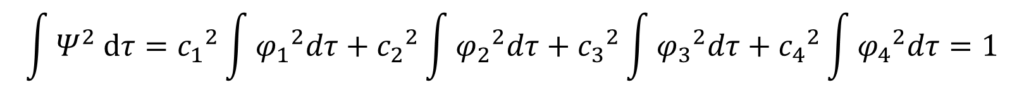

そして、同じ下付き数字のφの二乗の積分は1になるから・・・

あ!こんなに簡単になるのね!
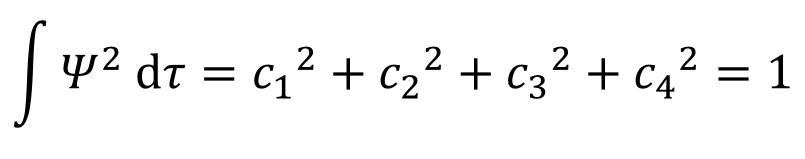

そうそう!あとは㉝式で求めたc2,c3,c4とc1の関係を代入していくだけたい。
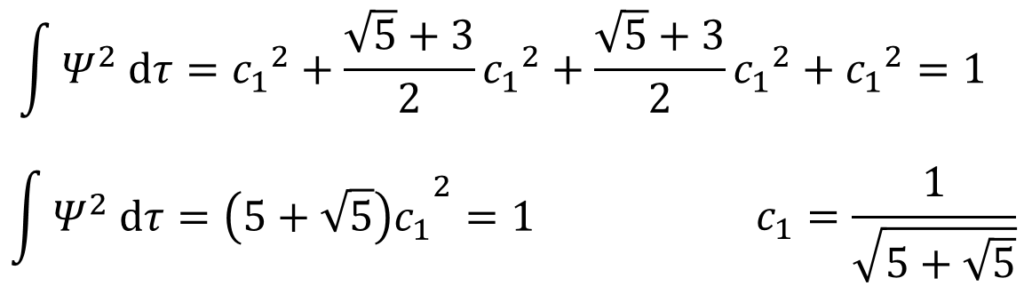

c1が求まったね!

これであとは、線型結合で表した分子軌道関数に㉝式の関係と、c1を代入していく。
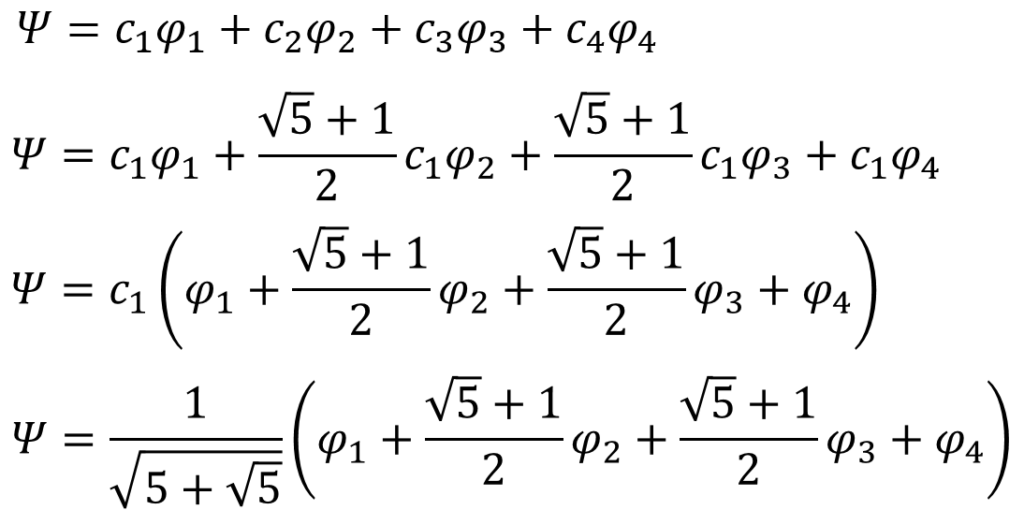

同じように他のエネルギーの値における分子軌道関数も求める。くどいんで計算過程は省略するけん。
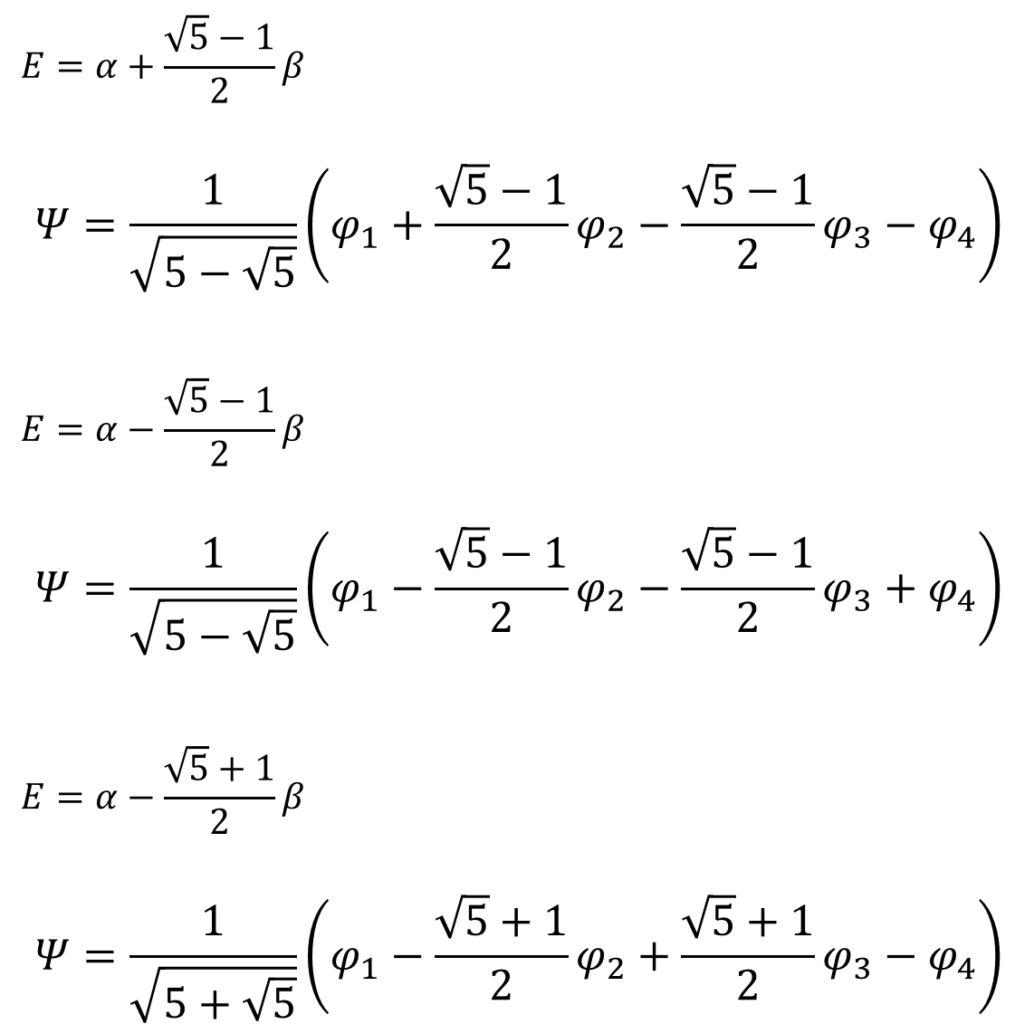

求めた分子軌道関数とエネルギーを図示するとこうなる。数字の大きさがわかりやすいように、根号を使わないで数字を表現した。
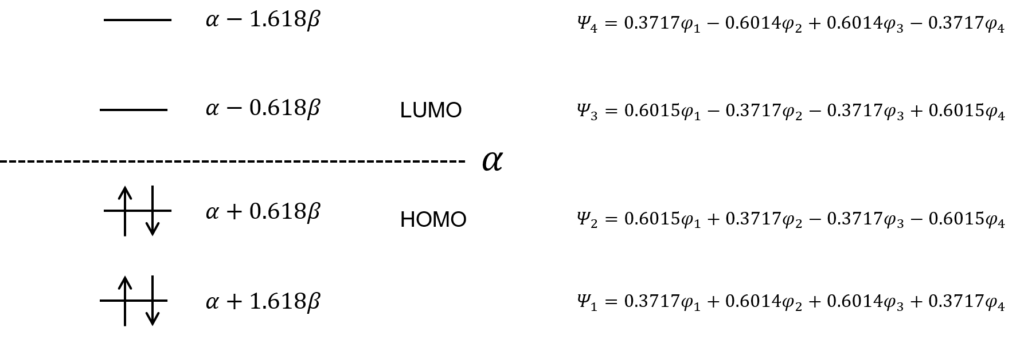
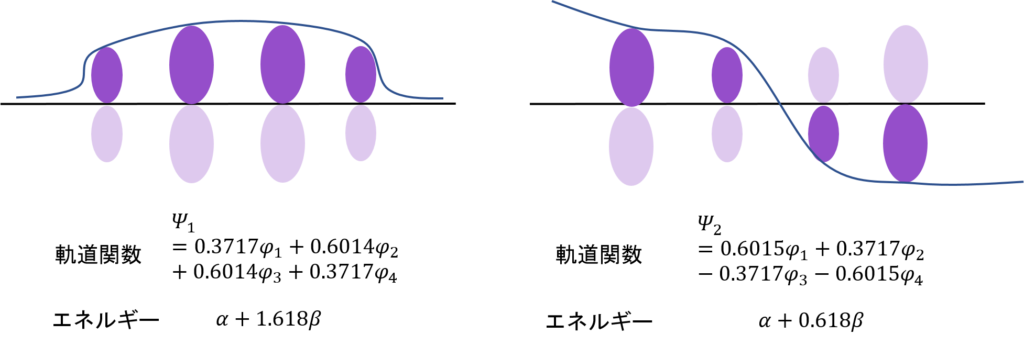
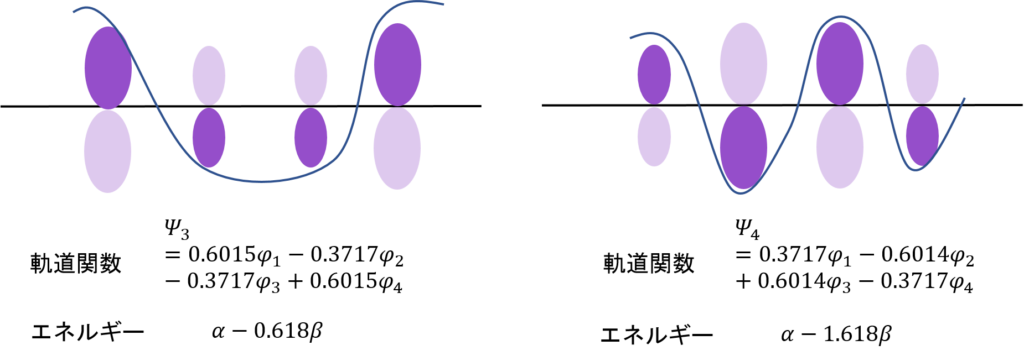

ノードが増えるほど、エネルギーが高くなっていくのはエチレンと同じね・・・。

そう。すべて同じ位相(全て同じ符号の分子軌道関数)にある電子の軌道関数はエネルギーが低い。広い範囲で電子が非局在化できるからな。
炭素原子のp軌道は分子を作ることによって、元々の軌道のエネルギーとは異なるエネルギー準位を作るようになります。電子は、元々の軌道のエネルギーよりも低い準位の軌道に収容されるので、分子全体のエネルギーは低くなるのです。
スポンサーリンク共鳴安定化と吸収波長
有機化学などの講義で、二重結合-単結合の繰り返しが長くなるほど、長い波長の光を吸収する、あるいは低いエネルギーの光を吸収する。と習った方もいらっしゃると思います。
この現象も、単純ヒュッケル法による分子軌道計算で説明することができます。

エチレン、ブタジエンよりももっと二重結合-単結合の繰り返しが長い、ヘキサトリエンのエネルギー準位を求めてみた。
解くべき永年行列式とその解を示します。
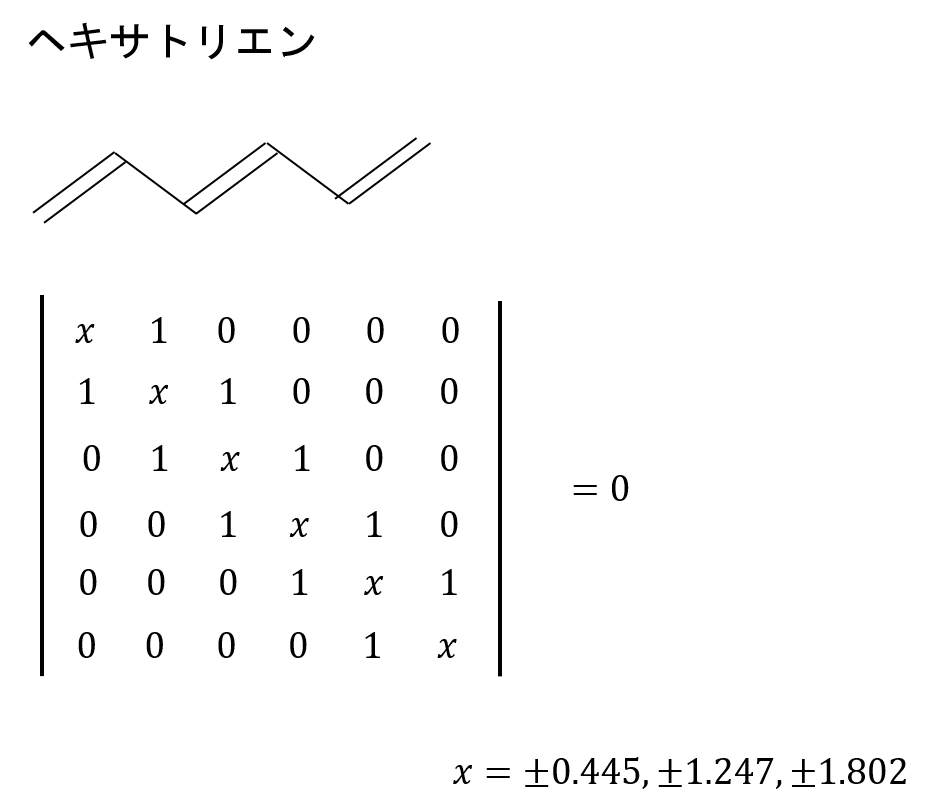
永年行列式の解から、エネルギー準位はこのようになります。
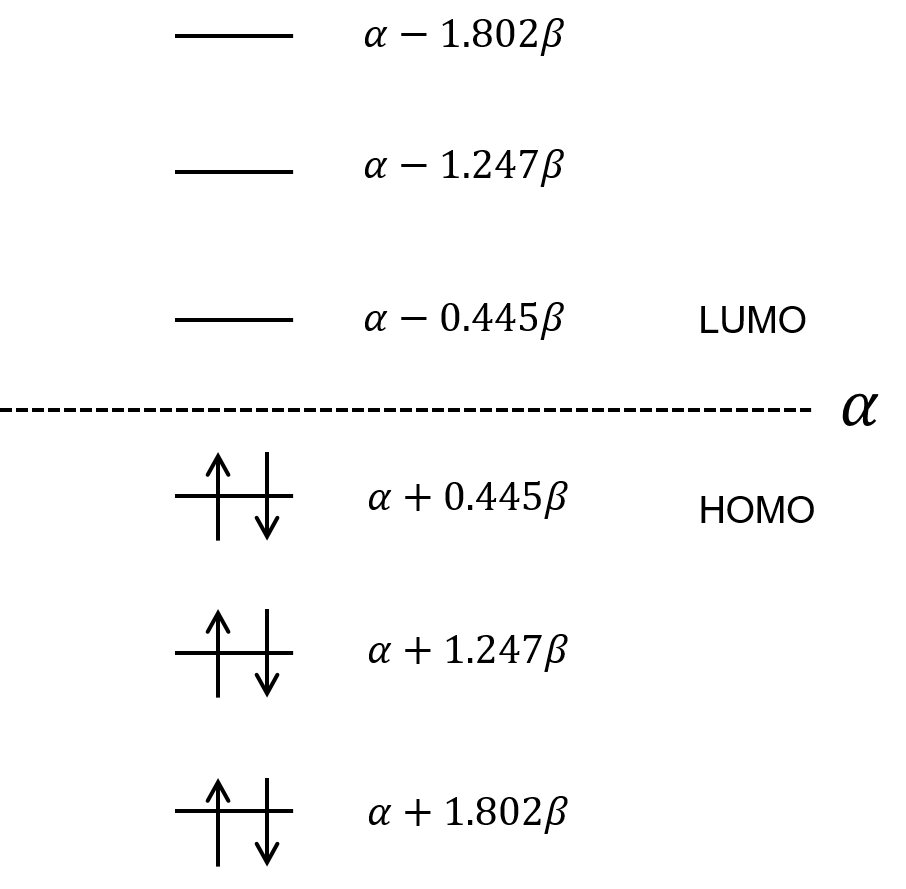

これまで求めてきた、エチレンやブタジエンのエネルギー準位と合わせて、3つの分子のエネルギー準位を並べてみるぜ。
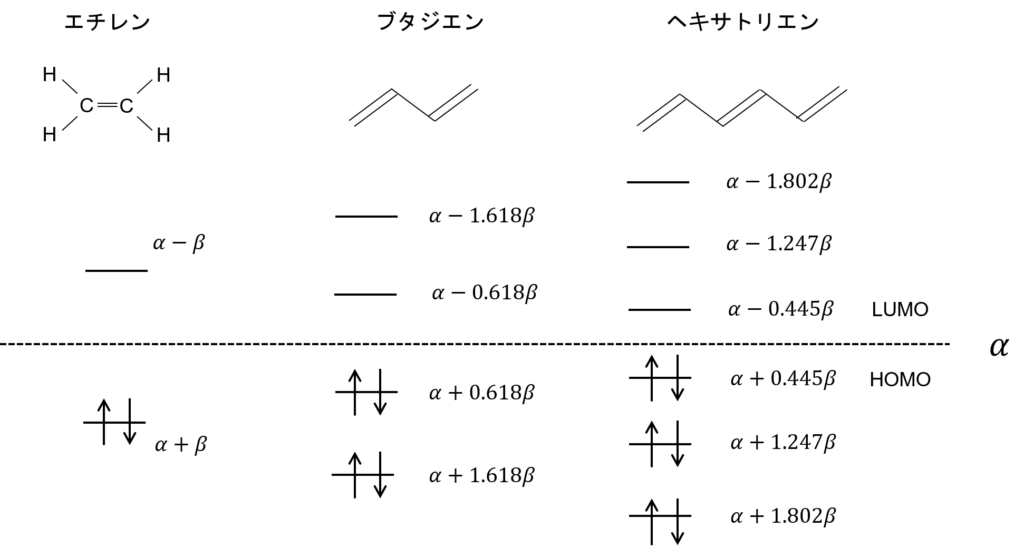

あっ!だんだんHOMOとLUMOの間隔が小さくなってくね!

うん。この二重結合-単結合の繰り返し、つまり、π電子の共役が長くなって、電子が非局在化できればできるほど、HOMO-LUMOの間隔が短くなっていくんだ。
共役が十分に長くなると、このエネルギーギャップが可視光の領域になる。そしたら、その物質には色がつくんだ。

共役が短いと紫外線を吸収するけど、共役が長くなると可視光を吸収するようになるのね。紫外線よりも可視光線の方がエネルギーが低いものね。

pH指示薬のフェノールフタレインってあるだろ?あれはpHが高くなると、構造が変わって、共役が長くなるから色がつくんだ。
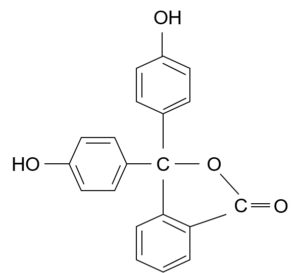
酸性・中性における構造
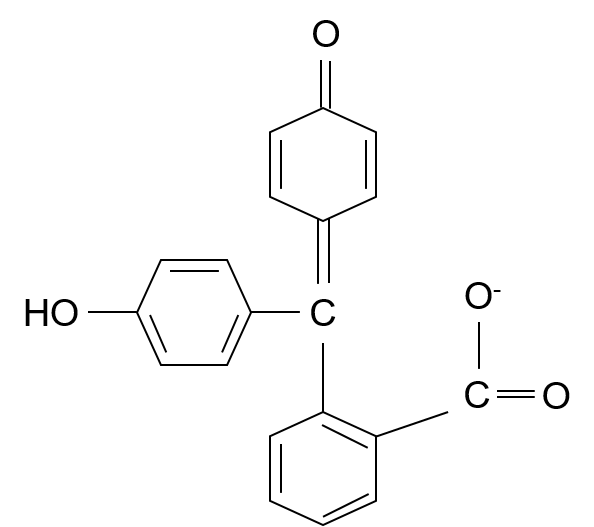
アルカリ性における構造

へぇ~そうなんだ~!確かにアルカリ性における構造は二重結合-単結合の繰り返しが長いわね!

な?おもろいやろ?専門的な勉強をすると中学校や高校で単に「フェノールフタレインはアルカリ性で赤紫色になります」って暗記させられていたものが、ちゃんと論理的に、具体的に理解できるようになるけん。
フェノールフタレインの構造変化の仕組みについて、こちらで詳しく解説しています。
[blogcard url=”http://shimaphoto03.com/science/phenolphthalein/”]
まとめ
今回は、単純ヒュッケル法による分子軌道の計算ということで、エチレン、ブタジエンについて永年方程式、行列式を立てて分子軌道とエネルギーを求めました。
永年方程式の立て方をマスターすると、色々な分子の軌道エネルギーを求めることができるようになります。
練習のために、アリルラジカルやシクロブタジエンなどを対象に計算してみてはいかがでしょうか。
 らい・ぶらり
らい・ぶらり


大変判りやすくて、ヒュッケル法が理解できました。
また、行列式のかんたんな解法助かりました。
省略なしに大変詳しく書かれていて、初心者にとってとても親切なページだと思います。ただ、「共鳴安定化」とは、複数の共鳴構造の寄与によりそれぞれの構造に比べて安定化するという考え方で、ベンゼンなどには当てはまっても、エチレン、ブタジエンなどに対しては当てはまりません。エチレンの場合は分子の形成による安定化、ブタジエンなどの場合は「非局在化」による安定化ということはできると思います。