資料請求番号:TS14
スポンサーリンク化学平衡とルシャトリエの原理
化学平衡は高校化学の中で比較的理解が難しい部類になるのでは、と思っております。化学の中でも計算量が多くあるうえに、どのように手を付けたらわからないという方もいると思います。
本記事では、まず化学平衡とは何なのか説明したのち、化学平衡に関する例題を解きながら、化学平衡の問題に慣れていただくことを目的とします。
化学平衡とは?
可逆反応とは?
化学平衡とは、可逆反応において、正反応の速さと逆反応の速さが等しくなり、見かけの反応が止まった状態のことを言います。

まず、ここから意味わからないねん!可逆反応ってどういうこと?
なんで正反応と逆反応の速さが一緒になったら見かけの反応が止まったようになる?

まぁ、まず、可逆反応から理解しに行こうぜ。例えばな、ハーバー・ボッシュ法によるアンモニア合成反応、N2 + 3H2 ↔ 2NH3があったときに、N2 + 3H2 → 2NH3が起こることもあれば2NH3 → N2 + 3H2が起こることもあるってことたい。

一回反応しちゃったものがなんで元にもどるん?

せやなぁ・・・・。

化学反応のエネルギー図は見たことあるか?こんな感じの・・・
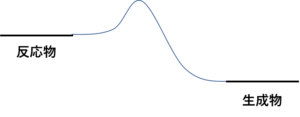

あるよ。ばってん、そのエネルギー図もようわからん。

化学反応のイメージはな、反応物の状態にあるボールがこの山を越えて生成物へ落ちるっていうイメージ
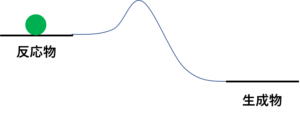

その反応物のとこにおいてあるボールがどないして生成物のところへ行くん?
ひとりでに山を越えることはありえへんやろ?

ありえないな。その考え方はええな。うん。ありえない。

で?

じゃあ、この模型をゆさゆさと左右に振ってみては?

ああっ・・・行った!!

これが反応するいうことたい。じゃあ、山越えて生成物のところに転がったボールがある。同じようにゆさゆさ振っても変化は起こらんかもしれんけどな

もっとゆさゆさ揺らしたらどうなる?

反応物のところに戻った・・・。

あ!これが可逆反応やけんね?

せやせや!反応物から見ても生成物からみてもな、山越えて隣の丘に到着するってのは同じたい。
せやから、反応は起きたらそこで終わり!じゃなくて、反応した後反応物に戻ることも普通にあり得る。

なるほど・・・。

模型をゆさゆさ揺らしてはどない言うたのは、揺らしたらボールが揺れるやろ?それはイメージできるか?

できるよ!

分子や原子いうのは、絶えず運動していてブルブル震えているたい。このことは、以前話したよな。

うん!確か3つの運動があるんやったな!

並進と回転と運動な。それがあるおかげで、ある分子は隣の分子とぶつかる可能性が出てくる。ぶつかったときにその分子同士が持つエネルギーが活性化エネルギー以上なら、化学反応が成立して、生成物へと向かう。

活性化エネルギーってこの幅やけんな?
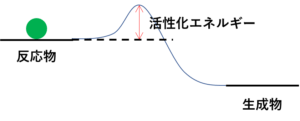

せやせや!ぶつかって活性化エネルギーいう山越えたら反応する。そして、反応物と生成物は行き来できるっていう風に考えればええよ。

なるほど~!
化学平衡とは?

じゃあ、この模型に置いた球。この球をな、たくさんにして揺らすことをイメージしてみな。
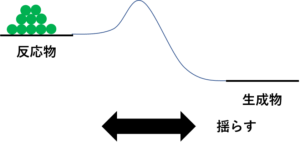

・・・・・・。

・・・・・・。

揺らし方は変えんと?

変えちゃいかん。常に一定のこう・・・強さで揺らすたい。

そしたらな、生成物のほうに8割くらい球が行って、反応物のほうに2割くらい残る。
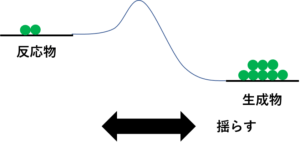

揺らし続けてもずっと?

ずっとや。

なぜ?

そげなこと・・・。

ええよ。ゆっくり考えて。

・・・・・・。

揺らしたときな、反応物のところから生成物のところへ行く球がほとんどやねんけど、たまに生成物のところから反応物のところへ行く球もあるけん、でそれでちょうどええ感じに2(反応物):8(生成物)くらいになると思うけん。

そのちょうどええ感じってのが、化学平衡たい。
もう一回、教科書に書いてある化学平衡の説明を読んでみ?
「化学平衡とは、可逆反応において、正反応の速さと逆反応の速さが等しくなり、見かけの反応が止まった状態のことを言います。」

あぁ~・・・。球のが反応物から生成物に行く速さと、生成物から反応物に行く速さが同じになった。
せやから、模型を揺らし続けてもず~っと、2(反応物):8(生成物)のままなんや!
化学の世界にも人間と同じで完全ばっかじゃないけん、「ちょうどええ感じ」ってのあるんやな!!

せやせや!むしろ、化学はちょうどええ感じに満ちているたい。
それを現したのがギブスの自由エネルギー言うてな、塩が水に溶ける物理的変化は吸熱の反応で、今のに例えれば球が上に登るような変化やのに、なぜ塩が水に溶けやすいか言うと、自由エネルギーはΔG = ΔH – TΔSで表されて反応物と生成物のエネルギー差ΔH、エンタルピー変化以外にも、エントロピー、つまりΔSという因子があってな、このΔS、すなわち乱雑さが大きなるけん、ΔHはプラスやのにトータルでΔGがマイナスになって安定になるから溶けやすいたいね。自由エネルギー言うのは化学の世界における「ちょうどええ感じ」の尺度で、これが低ければ低いほどちょうどええ感じになって反応が進む。こういうのを自発的変化言うたい。
ほかにも「ちょうどええ感じ」の尺度があってな・・・

・・・もういい。

・・・やっちまった。
平衡の移動~ルシャトリエの原理~
可逆反応が平衡状態にあるとき、濃度・圧力・温度などの条件を変えると新しい平衡状態になり、これを平衡移動といいます。その平衡移動は条件変化の影響を打ち消す方向に起こります。これをルシャトリエの原理といいます。
教科書的にルシャトリエの原理を説明すると、上記のような感じになります。それでは、平衡移動とは何なのでしょうか?ルシャトリエの原理をどのようにイメージしたらいいでしょうか?
「発熱反応において加熱すると平衡は左(反応物側)へ移ること」を例にルシャトリエの原理のイメージをまとめてみました。

化学平衡を習い始めたときにルシャトリエの原理ってのをやったやろ?

やった。条件を変えたら、その条件が打ち消す方向に平衡移動することやろ?アタシ、この問題は得意やけん。

じゃあ、この問題は?
N2 + 3H2 ↔ 2NH3 + 92.2 kJの反応が平衡状態にあるとき
(1)温度を上げる
(2)圧力を高くする
(3)NH3を除く
と平衡は左右どちらに移動するか出典:数研出版編集部編,『改訂版 リードα 化学Ⅰ+Ⅱ』,改訂版第4刷,pp.170,(2006)

これはな!(1)が左、(2)が右、(3)が右や!

正解!

やった!

なんで(1)は左なん?

これ、発熱反応やろ?温度上げたら、発熱しない方向、つまり左になるけん。

せやな。さっきの模型、思い出してごらん?2(反応物):8(生成物)くらいで球の数が分かれとる模型や。


これをさっきよりも強く揺らすたい。そしたらどうなる?

・・・・えっと。

4(反応物):6(生成物)くらいになるかな。
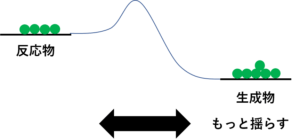

なぜ?

それはな、めっちゃ強く揺らしてん、生成物から反応物へのたかーい山を越えられる球が増えてくるけんね。それでちょうどええ感じになるのが4(反応物):6(生成物)くらいやと思う。

ええよ!ええよ!その考え。俺もそう思うたい。
めっちゃ強く揺らすいうことは温度をあげるいうことやな。

うん。温度を上げるとメッチャブルブルするけんね。

さっき、発熱反応だけん、温度上げたら平衡は左に移動する言うたな。

言うた。

あ!!

なになに?

2(反応物):8(生成物)くらいやったものが、強く揺らしたら4(反応物):6(生成物)くらいになるんやないやろうか?ってことと、平衡が左に移動するってこと、話かみあう!



せやせや!だんだんイメージついてきたやろ?
化学平衡の計算問題

ルシャトリエの原理の問題はわかるんやがなぁ・・・。

計算問題なるとわけわからんくなるけん。

そうか。例えばこんな問題か?
水素0.500molとヨウ素1.00molを混ぜ、ある一定温度に保つと全部気体となり、ヨウ化水素0.94molが生じて平衡状態に達した。この温度におけるH2 + I2 ↔ 2HIの平衡定数はいくらか。有効数字2桁で答えよ。
出典:数研出版編集部編,『改訂版 リードα 化学Ⅰ+Ⅱ』,改訂版第4刷,pp.173,(2006)

あ~こういうのや~・・・・

なるほど。とりあえずだが、この問題の場合、平衡定数はどんな式で表されるのか、わかるか?

えっと・・・こうやけんね。
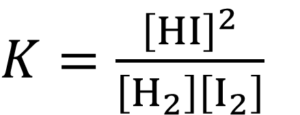

せやな。この式、説明できるか?

この、カッコ[]で囲んでいるヤツはそれぞれの物質の濃度で、例えば[HI]はヨウ化水素の濃度やろ?

どんなときの濃度?

平衡状態の濃度・・・・。

せやねん!平衡状態の濃度だけん、ヨウ化水素はわかろうもんが、水素とヨウ素の濃度がわからんけん、どうしたらええの?

まぁ、そうカッカすんなよ。問題が解けなくてムカつくその感情は成長するうえでは大切やけどな。
ファビーな、こんな感じの表を作ってみな。表の横に単位を書いておくのを忘れんといてな。
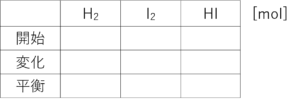

・・・うん。

それでな、この表を埋めていくたい。まず、「開始」の欄。問題文を読んで埋められるか?

こう?
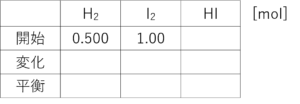

ヨウ化水素は?

・・・・。

問題文に書いとらんけん、わからんかもしれんけど、「水素0.500molとヨウ素1.00molを混ぜ、ある一定温度に保つと全部気体となり」と書いてあるやろ?水素とヨウ素を入れたんや。逆に言えばその2つしか入れとらんけん、つまり?

ゼロ?
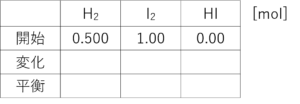

せやな!

次なんやけど、ヨウ化水素が0.94molなって、平衡状態に達した言うてるやろ?

うん。
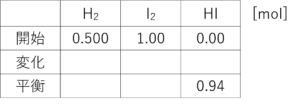

せやせや!ええ感じよ!

で、ここからが、ちと考えどころたいね。表の上に反応式を書いてみな。
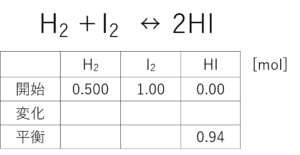

それで、ヨウ化水素が2個できる代わりに、水素とヨウ素をそれぞれ1個ずつ消費するたいね。これはわかるか?

うん。

じゃ、ヨウ化水素が0.94個できる代わりに水素と酸素はそれぞれ何個消費する?

・・・0.47個ずつ消費する。なんか、0.47個って違和感やけど・・・

あ、でも、molって個数やろ?0.47×6.02×1023個減るんや!そうやろ?

その通り!じゃあ、これまでの考え方で、ヨウ化水素が0.94mol増える代わりに水素とヨウ素が0.47mol減るってことがわかったったい。これを表に書き表すと
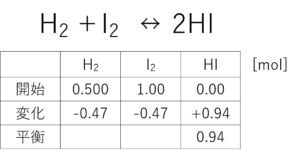

あっ!すごか!すごか!!開始と変化を足せば・・・
これで平衡状態の水素と酸素の濃度がわかるけん!

気づいたか?じゃあ、この表を完成させてみな。
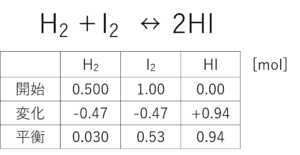

やった!できた!!

・・・あれ?

どうした?

平衡定数を求める式で必要なのは「濃度」やろ?molは濃度じゃなか。

その通り。濃度の単位は?

mol/L。でもな、体積わからんけん、どうしよ・・・。

もう!せっかくできる思たのにできないやん!こういうのせからし~わ~!

その気持ち、わかる。わかるけど落ち着いて考えてみようぜ。
体積わからんやったら、適当に文字を置いて計算進めてはどない?
例えば、V[L]で反応させたとする、そしたら、平衡の時のヨウ化水素の濃度は0.94/V [mol/L]やけん。

・・・うん。
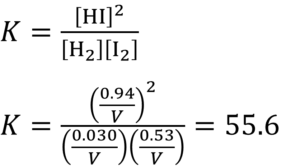

あ、Vが消えよった。

まぁ、こういうこともあるんよ。反応物と生成物での分子の個数が同じやとこういう計算ができるたい。
左辺も2個、右辺も2個やろ?

確かに・・・。

それで、55.6いう数字が出たけども、有効数字2桁で答えよ言うてるからな。

答えは56やけんね!やっとできた~!!

うれしいか?

うん!

その気持ち、大切にしてな。
まとめ
今回は、化学平衡を題材に、化学平衡の教科書的説明
「化学平衡とは、可逆反応において、正反応の速さと逆反応の速さが等しくなり、見かけの反応が止まった状態のことを言います。」
をかみ砕いて説明したあと、実際の計算問題例を解説しました。
化学も物理もイメージが大切です。理解して、関連の問題を解くことに慣れるようになるまでは、厳密さよりもイメージを大切にしたほうが良いかと思います。
例えば
・分子は震えている球で球同士が勢いよくぶつかったときにエネルギーの山を越え、反応が進む。
・生成物から見ても反応物から見ても山を越えることは同じだから、生成物と反応物が行ったり来たりすることはあり得る
・分子は球なのだから、個数で勘定する
などなど・・・。
そもそも、物理や化学というのは、身の回りに起きていることを数学で理解しようとする学問です。イメージが湧かないと数式にすることはできません。
高校生のうちは
公式を知る→現象を理解する(このステップがある生徒とない生徒で差が付きます)→問題に取り組んで慣れる→試験→合格
という流れですが、
大学へ進むとこの流れで単位を取ろうとするのに限界が訪れます。(過去問厨は除く)
現象を理解する→問題に適した公式を自分で作る→問題に取り組んで慣れる→試験→単位
という流れが必要になってきます。そして、研究開発活動を始めたら、この流れは必須になります。
そういう意味で高校生のうちから現象をイメージするクセをつけておけば良いかと思います。
 らい・ぶらり
らい・ぶらり


コメントを残す