資料請求番号:TS14 TS72
 スポンサーリンク
スポンサーリンク
化学反応の基本から反応速度式の導出を考える
大学入試や定期試験などで、反応式を与えられてそれをもとに速度式を立て、高校生ならΔC/Δtの形で代数方程式にして解き、大学生ならdC/dtの形で微分方程式にして解いて、
各物質の濃度変化などを考察する問題が出てくると思います。
私の経験上、反応式から反応速度式の導出は、できるようになるまで少々時間のかかる、考え方のコツの要る単元だと思いましたので、本ページを書くことにしました。
本ページでは、化学反応の基本を説明し、問題で与えられた反応式から反応速度式と、指定された物質の濃度変化を表す式を導出する方法を説明します。
化学反応の基本
gifで理解する化学反応

ああっ・・やっぱりわかんない・・。

どうしたん?

反応速度式の導出よ。「この反応式から、以下の速度式が・・・」って書いてあるけど、どうしてこの式になるのかよく分らないし・・・2乗だったり、2倍だったり、この時は2倍するのか、1/2するのか・・・・。

そっか・・・せやったら、そもそも化学反応で何が起こっているんか、考えないといかんな。

化学反応で・・・・何が・・・?起こってる???

例えば、こんな化学反応があったとしたら?

青い球と緑の球がぶつかって赤い球になる。

・・・うん。
化学反応のイメージ(gif)


あ~化学反応では青と緑の球がぶつかって赤になって・・・の繰り返しなんだ。

こういうのをな、式にして表して、計算できるようにして、反応時間とか知りたい情報を得るのが化学反応速度論で、その第一歩が化学反応速度式を立てるということ。

・・・わかったようなわかんないような。
化学反応速度が反応物の濃度の積になる理由

じゃあ、この式の反応速度式はどうあらわされる?v=の形で表してみ
![]()

・・・こう?
![]()

せやな。「反応速度は反応物の濃度の積で表される」と授業やら講義やらで言われるよな。
なして?と思わん?
なして?と思わん?

あんまり思わなかったかも

そうやって丸暗記するから、問題が複雑になったときに苦労するんやで。

なんで説教されなきゃいけないのよ!?だってしょうがないじゃない!わかんないもんはわかんないんだもん!!わからないものは置いておいて、わかったもので点を取れるようにする!

そしたら、1回ヤマを外して1年間彷徨い、何とか旧帝大に入ったものの、単位を落としたり、院試の順位は下から数えたほうが早く、そして今も劣等感を抱えながら生き続ける・・・・。

やめて・・・。

確かに、この辺はわかりづらか。
せやから、直感で理解できるような図を作ってみた。
せやから、直感で理解できるような図を作ってみた。

さっきのヤツな。初期状態。


うん。

で、ここで緑色だけ個数を2倍にしてみた。そしたら、青と緑がぶつかる確率は何倍になるか?
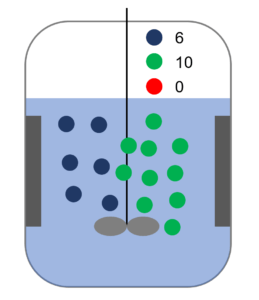

2倍。

せやな。特に何も考えることはないな。
じゃ、次に青の数も2倍にしてみる。そしたら?
じゃ、次に青の数も2倍にしてみる。そしたら?
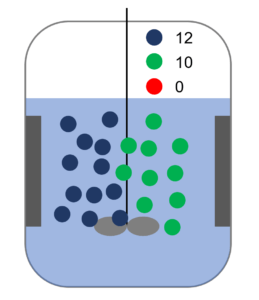

また2倍になるね。

この状態と比較したら?


あ・・・4倍になってる・・。

それが、こういうことなのね。

せやで。A+B→Cの反応速度はv = k[A][B]となる。ということを暗記するよりも、
アタマの中がスッキリしたやろ?
アタマの中がスッキリしたやろ?

うん!
擬1次反応のイメージ

化学反応速度の表現には擬1次反応ってもんがある。

あ、聞いたことあるよ。なんか、溶媒と溶質が反応する系で、溶質の濃度<<溶媒の濃度だから、溶質の濃度だけ考慮すればいいって話だよね?
よくストーク、「これは擬1次でええのか、2次なんか・・・」ってボソボソ言ってるじゃない。
よくストーク、「これは擬1次でええのか、2次なんか・・・」ってボソボソ言ってるじゃない。

・・・せ、せやな。(独り言聞かれるんば、恥ずかしか・・・。)

擬1次反応の例としては酢酸エチルの加水分解反応がある。

酢エチを緑の球、水を青球とすると反応器内のイメージとしてはこんな感じ。
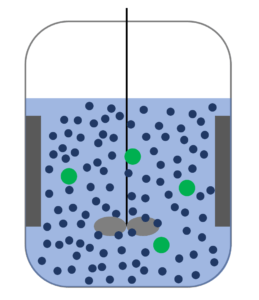

酢エチと水がぶつかれば加水分解が進むわけやが、別にこの状態で青球の数が2倍になったところで、緑球と青球がぶつかる確率はそう変わらんやろな、ってのが擬1次反応たい。

なるほどねぇ~。でも緑球の数が2倍になったら、ぶつかる確率は2倍になりそうね。
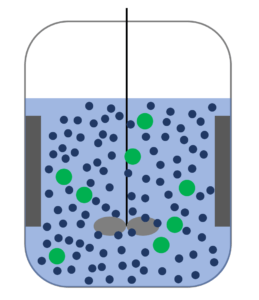

せやせや。せやから、本来は2つの化学種が関わる反応やけども、こんな風に式を立てて、反応速度は緑球の濃度だけに依存するとしてしまう。これが擬1次反応たい。
![]()
反応速度式の立て方
例題① A+B→C

それでだな、
ぶつかれば反応する(※活性化エネルギー以上で)
ぶつかる確率は濃度が上がれば上がる
こういった基本を抑えたところで、反応速度式を立ててみようか。
ぶつかれば反応する(※活性化エネルギー以上で)
ぶつかる確率は濃度が上がれば上がる
こういった基本を抑えたところで、反応速度式を立ててみようか。

こんな問題

求めたいのは2つ?

えっとな~。2項目で、その内訳は反応速度式1つと方程式3つといったところたいね。

こうかしら・・・?
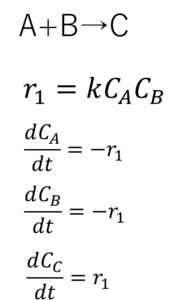

おっ、正解。どうやって考えた?

なんとなく。

・・・・・。

・・・・。

まぁ、あれやな。なんとなくで正解を導くチカラってのも重要やけどな。じゃあ、こういうのは?
A+2B→2C+3Dと2A+C→2Dの二つの複合反応からなることが分かっている。
それぞれの反応の反応速度式と5つの物質の濃度の経時変化を表す方程式を立てよ』

・・・・無理。

せやろ?せやから、アタマでしっかり、論理的に理解しような。
例題① A+B→C 解説

もう一回この問題に戻るで。

まず、反応速度式やけど、これは反応の数だけ存在する。この問題は1個だけな。

2個以上ってどういう場合なの・・・?

「複合反応」とか「逐次反応」とか「平衡反応」とかそういうヤツら。いくらでもあるで。あとで解説する。

そして、その反応速度式というのは、反応物の濃度で決まる。せやから、反応速度式を立てるとなれば、左辺だけ見ていればええわけやな。

そっか。さっきのアニメーションでも、青、緑の数は反応速度に関係しているけど、赤球の数は関係なかったもんね。

A+B→Cの反応速度式として立ち上がる式ってのがこれな。
![]()

それで、次に、反応中の各物質の濃度変化を求める式なんやが、これは高校化学だと変化分の平均を使うが、大学に進めば微分方程式になる。

これで、正解や。ようプラスマイナスを間違えるヤツがおるけん、なして、AとBはマイナスにして、Cはプラスにしたん?
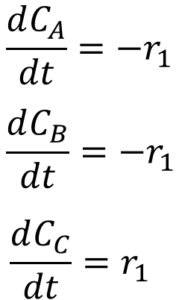

えっと・・・えっとね・・・。

ええよ。ゆっくりアタマん中整理すれば。
・・・・

AとBはなくなっちゃうけど、Cはできあがるら?そんな感じ。

せやで。そんな感じで考える。
AとBは反応で消えていく。せやから、Aが変化していく速度を表した左辺とイコールで結ばれるべきはマイナスなんや。Cはその逆やな。
AとBは反応で消えていく。せやから、Aが変化していく速度を表した左辺とイコールで結ばれるべきはマイナスなんや。Cはその逆やな。

たまに、r = –kCACBみたいに反応速度式をマイナスで書く先生とか教授、教科書あるじゃない?そしたら、さっきのプラスマイナスはひっくり返るのよね・・・。わかりづらい。

それはわかるなぁ~。せやから、r = ・・・に続く式は絶対に正の数値にしておく。そのうえで反応で減っていくものに関してはdC/dt = -rみたいにマイナスでつなぎ、反応で増えていくものに関してはプラスでつなぐ。
この自分ルールを確固たるものにしておけば混乱は抑えられる。
この自分ルールを確固たるものにしておけば混乱は抑えられる。

教科書や専門書を自分流で読み替えるのね。

せやで。スンナリ難関に合格するヤツとか、その大学でスンナリAとかBで単位をとってしまうヤツってのは、教科書や専門書を自分の言葉で理解し、自分の言葉でまとめとるヤツやけん。

え?SとかAじゃなくて?

Sとかなかったで。Aが90~、Bが80~。

ワタシの大学はSが90~でAが80~だった。

え~なんやねんそれ!ズルか~!俺の大学ばABCDFやってん!

そうね。成績表をパッと見たときの見た目はSABCDタイプの評価の方がいいわね!

でも、どうせ、オマエの成績表はBCBCBABDみたいな感じやろ?

はいはい。その通りですよ!
例題② 逐次反応 A→B→C
『A→B→Cで表される反応の反応速度式および各物質濃度の経時変化を求める方程式を示せ。』

こういう反応を「逐次反応」っていうたい。A→Cの反応なんやけども、途中に中間体Bがあるっていうな。

どうしてA→Cとして取り扱っちゃいけないの?

例えば、A→Bの反応は速いが、B→Cの反応が遅い場合とA→Bの反応は遅いが、B→Cの反応が速い場合。この2パターンを考えよう。
では、A→Cの反応は?はやか?おそか?
では、A→Cの反応は?はやか?おそか?

おそい。だってどうせ、どっちかの反応が遅ければ、結局遅いら?

その通りたい。じゃあ、この反応を速くしたい。方法はいろいろ、温度プロファイルを変えたり、触媒を工夫したり。それをするための情報がA→Cのような解析結果で得られるか?っていう話。

そっか。同じ「遅い」でもどっちが「遅い」のかで対処法が変わってくるんだけど、A→Cのように取り扱ってしまうとどっちが「遅い」のかわからなくなっちゃうのか・・・。

その通り。全体としての反応速度は、反応の遅い過程で決まってしまうわけやから、そこの対処に力を入れればいいことがわかるな。これを反応の「律速段階」という。

あ~それ、化学系の人よく言ってるよね。
「なに律速?それなに律速???」って。
「なに律速?それなに律速???」って。

せやろ?オマエやって処理に時間のかかるアルゴリズムを見つけ出して、それをプログラム更新の優先順位の上位にもっていくわけやないか。

うんうん!

そこでA→B→Cの反応系やが、これで反応速度式と各物質の濃度の経時変化を予想する方程式を立てられるか?

・・・う~ん。
・・・・・

わかんない。

せやったら、このA→B→Cの逐次反応をこんな風に2つの反応として取り扱ってみてはどんな?

・・・・

こう?
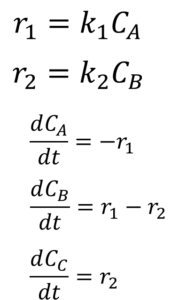

おっ、正解。どんな風に考えた?

えっと、1つ目の反応はA→Bで、左辺の物質、Aの濃度だけに比例する速度式r1ができて、
2つ目の反応はB→Cでこれも左辺の物質、Bの濃度だけに比例する速度式r2ができて・・・
2つ目の反応はB→Cでこれも左辺の物質、Bの濃度だけに比例する速度式r2ができて・・・

ええなぁ!それで?

Aはr1の速さでなくなっていくだけだら?それで少し考えたのがB成分で、1つ目の式にも2つ目の式にもあるら?
でも、1つ目の式で考えれば増えてくから+r1になって、2つ目の式で考えればなくなっていくから-r2で総じて考えればr1–r2なのかな~と。Cはr2の速さで増えるだけだからr2ね。
でも、1つ目の式で考えれば増えてくから+r1になって、2つ目の式で考えればなくなっていくから-r2で総じて考えればr1–r2なのかな~と。Cはr2の速さで増えるだけだからr2ね。

ええ感じの考えになってきたなぁ~

・・・。

でも、オマエ、最初これできんかったやろ?

・・・。

俺がどんなアドバイスをしたらできるようになった?

・・・反応を分解、というか、要素要素に分けて考えた。

せやな。複雑な問題は実は簡単な問題の集合体だったりする場合が多いたい。プログラミングやってそうやろ?パッとコードを見たら「うわぁ・・」ってなるけど、一つ一つクラスを追っていけば、コードの全容が見えてくるやろ?

確かに・・・・。

複雑な問題は分解して考える。これは自然科学の基本やと思う。この問題はその一例や。
例題③ 平衡反応 A+B⇔2C
『A+B⇔2Cで表される反応の反応速度式および各物質濃度の経時変化を求める方程式を示せ。』

これは・・・・正反応と逆反応に分けて考えればいいから・・・こう?


せやな。

それで・・・

えっと・・・

こう?
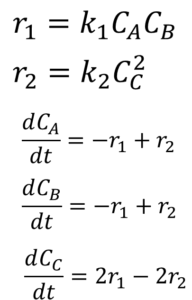

せやせや。正解。

あ~よかった~。

ただ、dCC/dtでちょっと迷いがあったようやが・・・。

うん。そうなのよ~。でもね。物質Cができる速度を記述しているっていう考え方に立ち返ったら、r1の速度で表される反応が1回行われたら、Cが2個できる、逆にr2の速度で表される反応を1回行うにはCを2個消費するって考えたら、2r1-2r2なのかな~って思って。

おおっ、ええな。その考え方。これなら、量論係数がいくつになろうが怖くないやろ?

うん!
例題④ 複合反応
『3A+2B→C+5Dなる反応がある。この反応は
A+2B→2C+3Dと2A+C→2Dの二つの複合反応からなることが分かっている。
それぞれの反応の反応速度式と5つの物質の濃度の経時変化を表す方程式を立てよ』

これ、最初の方に言った問題や。ばってん、今ならできるやろ?

えっと・・・。
・・・・

こう?
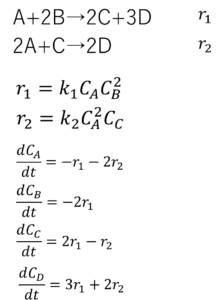

正解や。慣れてきたなぁ~!

Aがr1の速度で減って、これと同時に2r2の速度で減っていくのよね。
Cは2r1の速度でできてくるんだけど、同時にr2の速度で減っていくのよね。
Cは2r1の速度でできてくるんだけど、同時にr2の速度で減っていくのよね。

せやせや。そういう考え方。
まとめと注意点
まとめ

今回はな、反応式から反応速度式と反応にかかわる各物質の濃度変化を表す方程式の作り方ということで解説したんやけども、
これ、何に役に立つと思う?
これ、何に役に立つと思う?

そりゃあ、ねぇ。受験化学で少しでもいい点を取るっていうのと・・・
あと、ウチの会社で反応器作るのに使うんでしょ?この知識。
あと、ウチの会社で反応器作るのに使うんでしょ?この知識。

せやねん。応用例としてはこんな感じ。

ふぅ~ん・・・。
これで反応器を設計するのに必要な基礎式が作れるんだ・・・。
これで反応器を設計するのに必要な基礎式が作れるんだ・・・。

せやで。今回やったことは高校化学、一部は大学の物理化学っていう範囲になるわけやけどもな、製造業においても非常に重要なことやけん・・・。

多分、ワタシ、この基礎式を解くプログラムを作るの、手伝わされるんだ・・・・。
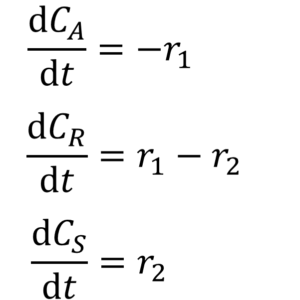
出典:[blogcard url=”http://shimaphoto03.com/science/batch/”]

せやで。たのむわぁ~。

まったくしょうがないなぁ~・・・。じゃあ、今度作ってあげる。
※完成プログラム(2018年5月3日追記)
[blogcard url=”http://shimaphoto03.com/science/batch-vba/”]

いやぁ~助かるわぁ~。
注意点

あと、反応速度式、r1とかr2とかについてA+B→Cならこれ

A+B⇔2Cの平衡反応ならこれ


みたいにr=の式を作ったわけやけどもな、必ずしもaA + bB→・・・ならr=k[A]a[B]bになるとは限らんたい。

え?

せやから2A→Cがr = k[A]の一次反応である可能性もあるということ。

え~!!じゃあ、ワタシが学んできたのはなんだったわけ~!!?

まぁ、そう怒るなよ。これが真実なんやから。ばってん、dCA/dtのような物質収支式の立て方は普遍的なものやで。
せやから対象とする反応のr = の中身を反応式だけで決めつけんと、「ナントカカントカ反応の速度論的研究」みたいな論文を読むか、文献がない場合は自分で実験して調査する必要があるということたい。
とにかく、調査が必要なんやけども、1段階目の仮説として「aA + bB→・・・ならr=k[A]a[B]b」という関係を使うということたい。
せやから対象とする反応のr = の中身を反応式だけで決めつけんと、「ナントカカントカ反応の速度論的研究」みたいな論文を読むか、文献がない場合は自分で実験して調査する必要があるということたい。
とにかく、調査が必要なんやけども、1段階目の仮説として「aA + bB→・・・ならr=k[A]a[B]b」という関係を使うということたい。

どうして2A→Cが2次反応って決められないの?

化学反応ってのは色々なパターンがあってな、2A→Cだからって、一概に2個のAがぶつかってCになるって言いきれんけん、その辺、詳しく知りたいんなら、「反応機構」っていうのを調査してみるとええ。

あぁ・・・。

逆に言えば、これだけで化学反応をわかった気になっちゃうのが危ないのか・・・。

まぁな。俺らの勉強には終わりがないということたいね。
 らい・ぶらり
らい・ぶらり

コメントを残す