資料請求番号:TS61
スポンサーリンクアルカリ性になると赤紫色になる理由を構造式から解説
現在、2学期が終わりに差し掛かっていて、中学生や高校生は期末テストの勉強が大変だと思われます。
先日、私が乗車したバスの中で、私の出身中学校の生徒たちが、5教科の問題を出し合っていて、なんだか懐かしくなりました。
その中で「フェノールフタレインはアルカリ性になると何色になる?酸性だと何色?」というような問題が聞こえてきました。
フェノールフタレインはアルカリ性になると赤紫色になり、酸性では無色です。
※非常に強い酸性、アルカリ性ではまた違った色を呈しますが、基本、中学・高校生の範囲では上記の答えが正解でしょう。
では、なぜフェノールフタレインはじめ、色々な指示薬は酸性、アルカリ性、すなわちpHが変化すると色が変わるのか、疑問に思いませんか?
今回の記事では、フェノールフタレインがアルカリ性になると赤色になる理由を、化学構造を使って説明したいと思います。
フェノールフタレインの基本情報
使い方
まずは、フェノールフタレインとは、どんな物質でどんな使われ方をされているのかをご説明します。
フェノールフタレインは酸塩基指示薬の一つで、アルカリ性、もっと詳細に言えばpH8.0以上になると赤紫色を呈します。したがって、対象とする物質がアルカリ性なのかどうかを知ることができます。
さらに、フェノールフタレインを入れた強塩基の試料に対して、酸性の液体(塩酸、酢酸、シュウ酸など)を入れていき、無色になった瞬間の酸性液体の使用量から、強塩基の試料の濃度を求めることができます。
この化学分析方法を中和滴定と呼びます。高校化学で中和滴定の計算をすることがありますね。
このフェノールフタレイン。変色域がアルカリなので、強酸と弱塩基の組み合わせでの滴定には不適切です。なぜなら強酸と弱塩基の組み合わせでは、中和点のpHが低くなる(酸側に傾く)からです。
滴定をしていると、pHが急激に変化する領域があります。そこが中和点であり、そこで試料の塩基濃度と酸濃度が同じになります。
そのpHが酸の領域だと、フェノールフタレインは無色のままなので、終点が分からなくなるのです。
強酸と弱塩基の組み合わせではメチルオレンジを使用します。

アタシの職場では、工場から持ってこられたドロドロに溶けたパルプの苛性濃度をこの機械を使って測っているんだけど、
16時ごろ、朝勤が帰るときか夕勤が出勤してきたときに一回だけ手で滴定して機械の調子を見るの。その時の指示薬はフェノールフタレインやね。

ああ、この機械って自動滴定装置か。いや~便利だなあ。ウチの工場の場合は水酸化ナトリウム、すなわち苛性を使ってパルプをドロドロにしていているから、その塩基濃度を測るのにフェノールフタレインを使うのは正しい。入れてる酸の種類はなんだ?

塩酸だよ。だからフェノールフタレインでも、メチルオレンジでも大丈夫。

そうだな。強酸と弱塩基の組み合わせではpHが3から12くらいまで急激に変動するから、メチルオレンジ使おうがフェノールフタレインを使おうが同じなんだよな。
フェノールフタレインは強酸と強塩基、弱酸と強塩基の組み合わせの中和滴定に使用できるのです。
構造
フェノールフタレインの構造式は以下の通りです。
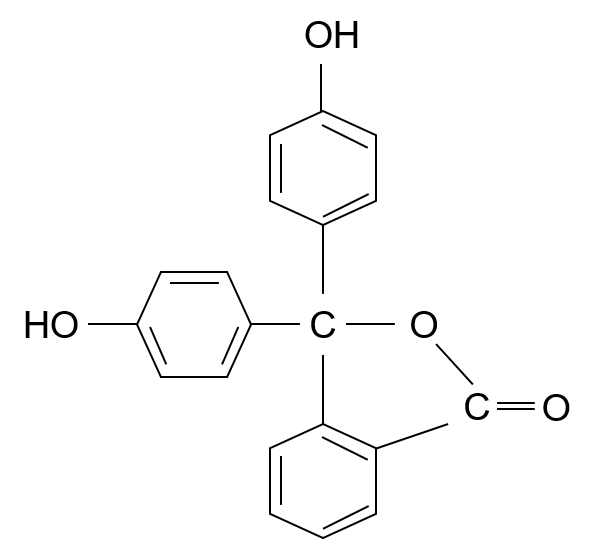 ・・・①
・・・①

うわっ、アタシ、もう無理や。

まぁまぁ。この構造はpH8.0未満、すなわち無色の時の構造式だ。そして、pH8.0を超えるとこうなる。
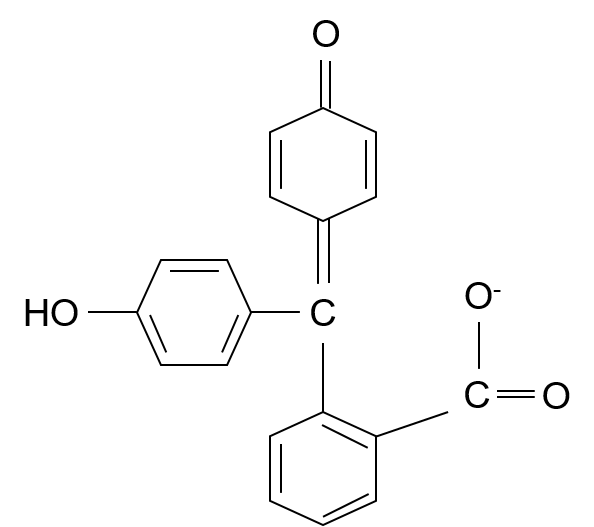 ・・・②
・・・②

やっぱりわかんない。

何が分からん?

構造式の意味もよく分からないし、pH8を超えたら2つ目の構造になる理由も分からないし、2つ目の構造で色がつく理由も分からない。
大体、①を塩基性にするだけでなんでこんなに構造が変わっちゃうの?

じゃあ、それらを一つずつ説明していくぜ。
フェノールフタレインが発色する理由
ダイジェスト版

フェノールフタレインが塩基性になると発色する理由は構造が変化するからなんだ。元々フェノールフタレインは弱酸性物質で、pHが上がっていくと、フェノールのOH基のHが外れ、O–になる。
そしたら、ラクトン環が破壊されて、②のような形をとる。そしたら、π電子が移動できる範囲が広くなるので物質としては安定な方向になる。これを共鳴安定化という。
元々①では、各ベンゼン環だけの範囲でπ電子が自由に動き回り共鳴安定化していて、その吸収波長は約260nm。しかし、広い範囲で共鳴安定化した②の構造では500~600nmが吸収波長になる。この波長は可視光で緑色の波長の光だ。この光が吸収されてフェノールフタレインは赤紫色になる。

もう全然わからないよ~!!ディープル、助けて!!

えっ?えっ?僕!?
詳細説明:pHによる構造の変化

まず、①の構造の状態でpHが上がっていくと、フェノールのOH基のHが外れるんだよね。具体的に言えば水酸化物イオンがOH基のHを奪って、水になるんだよ。
そしたら、こんな構造になるよね。・・・と言っても、①の構造からフェノールのHを消しただけなんだけど。
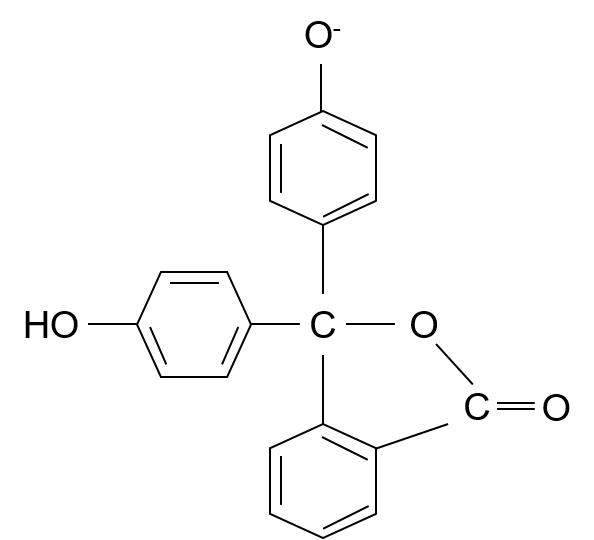

そしたら次はO–の部分に電子がたくさんあるから、電子が矢印で描いたように移動していくんだ。
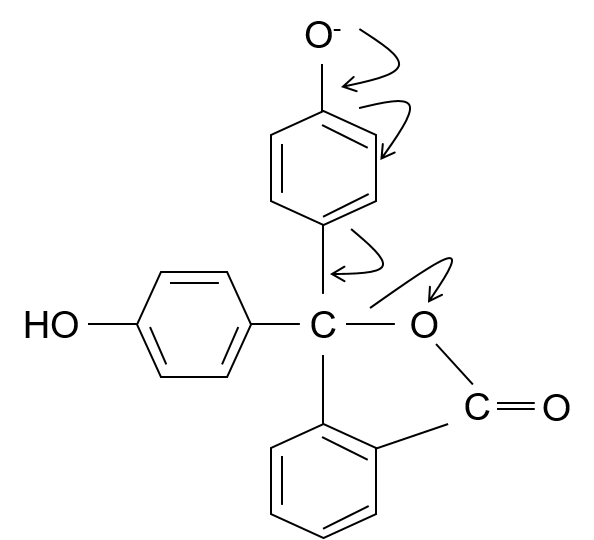

そして②の構造が完成する。
 ・・・②
・・・②

とりあえず、矢印の行った先で2重結合が出来たり、マイナスの電荷が与えられたり、電子が奪われると結合が切れるような感じはなんとなくわかったよ。

そう・・・よかった・・。
詳細説明:共鳴安定化と発色

それで②の構造を見てみると、二重結合、単結合、二重結合、単結合・・・の繰り返しがあるよね。この繰り返しをπ共役と言って、この繰り返しの区間では電子が自由に移動できるんだ。
そうすると分子全体のエネルギーが下がるんだ。この現象を共鳴安定化っていうんだ。

①と②とでは、共鳴安定化の度合いが②の方が多いから、安定なのね。

そうなんだ。分子全体のエネルギーが下がっていくと、エネルギーギャップが小さくなって、よりエネルギーの低い波長の光を吸収するようになるんだ。

・・・よく分からないけど、共鳴安定化すると、エネルギーの低い波長の光を吸収するってことでOK?
※エネルギーギャップについて、詳しい説明はこちら
[blogcard url=”http://shimaphoto03.com/science/absorption/”]
※共鳴安定化と吸収波長の関係は分子軌道計算によって説明することができるようになります。
[blogcard url=”http://shimaphoto03.com/science/molecular-orbital/#wave”]

うん。①では、各ベンゼン環の中でしか共鳴安定化できないから、エネルギーの高い波長の光、つまり短波長の光を吸収するんだ。その波長が260nm。これは紫外線の領域だから、人間の目には何も吸収が起こっていないようにみえる。だから、①の構造、つまりpH8.0未満だと無色なんだ。
でも、②では広い範囲で共鳴安定化しているからエネルギーの低い光、つまり長波長の光を吸収する。それが500~600nmの光なんだ。これは人間の目に見える波長の光で緑色の光なんだ。この光がフェノールフタレインによって吸収されると、その補色、赤紫色が見えるんだ。

これがアルカリ性になったらフェノールフタレインが赤紫色になる理由だよ。

なんかちょっとわかった気がする!ありがと!

あ・・うん。

おおっ、ディープルスゲェな。俺の説明をあれだけで理解して話したワケ?

えっと・・・。有機化学は引きこもっていた時に勉強していたから。僕も酸塩基によって色が変わるのはなぜだろうと思っていたんだ。それをちゃんと説明するには有機化学の知識が要ると思って

へぇ~独学でやってたんだ~。すごい。

ありがとう。
まとめ
今回は酸塩基指示薬の一つであるフェノールフタレインがなぜアルカリ性の状態で赤紫色になるのかを
pH変化による構造変化、構造変化による共鳴安定化の視点から説明しました。
内容をもう一度復習してみると
pHが8.0以上になると、フェノールのOH基のHが外れて、電子が移動して②の物質ができる。この時にラクトン環が開裂する。
②は①に比べて、π共役の長さが長く、共鳴安定化の度合いが大きいので紫外線と比べてエネルギーの低い可視光を吸収する。その結果として、フェノールフタレインは赤紫色に見える
という形になります。
中高生はアルカリ性の溶液にフェノールフタレインを入れると赤紫色になるとだけ勉強しますが、その理由には大学で勉強する有機化学で説明される現象があるのです。
なぜ、色が変わるのか?不思議に思ったら、好奇心が湧いたら少し背伸びしてその理由を探索してみると面白いですね。
 らい・ぶらり
らい・ぶらり


助かりました。説明とてもわかりやすいです。ありがとうございました。
コメントありがとうございます。
わかりやすいという言葉をいただき、光栄です。
これからもよろしくお願いいたします。
私はコロンビア出身で、化学の宿題のために、必要な質問を他の言語に翻訳してgoogleで検索するのが好きです。ご説明ありがとうございました。
追伸:おそらく、文章が稚拙だったり、スペルミスがあったりするのは、オンライン翻訳機を使ったからだと思います。本当にありがとうございました。