炎色反応の原理を量子化学的に解説|金属特有の光が生まれる仕組み
資料請求番号:TS22 TS82
炎色反応で金属ごとに色が違う理由などを量子化学の観点から詳しく解説
炎色反応は金属を燃焼させたときに金属特有の発色を呈する現象のことで、中学校の理科で勉強します。
本記事では理論を主体として高校生~大学生向けに炎色反応の原理をより専門的に詳しく説明することを目的にしています。
電子配置図
高校で習う電子配置図はいいかげん!!?
 ストーク
ストーク
高校化学では、以下のような図を使って「ナトリウムの電子配置は合計11個の電子がK殻に2つ、L殻に8つ、M殻に1つ配置されている」という習い方をする。

 ストーク
ストーク
実はこれだけでは、ナトリウムの炎色反応の厳密な説明はできん。
 シママ
シママ
え~??そうなの?だって、熱エネルギーで電子が高いエネルギーになって、それが元に戻ることで発光するって説明だったじゃない。電子はM殻からN殻に移動したんじゃないの?
 ストーク
ストーク
実はN殻じゃなしに、同じM殻内のエネルギーの高いところに遷移したと考える方が妥当たいね。
 シママ
シママ
???
 ストーク
ストーク
これを理解するには、KLMっていうエネルギーの表し方から脱却して、
主量子数・方位量子数・磁気量子数
という考え方が必要になってくる。
 シママ
シママ
ますますわかんない・・・。
 ストーク
ストーク
結論から言うとな、ナトリウムは以下のような電子配置をしていて、3pから3sに遷移するときのエネルギーギャップをE = hνで表現したとき、589nmつまり黄色の波長の光になるから、
ナトリウムの炎色反応は黄色といえる。
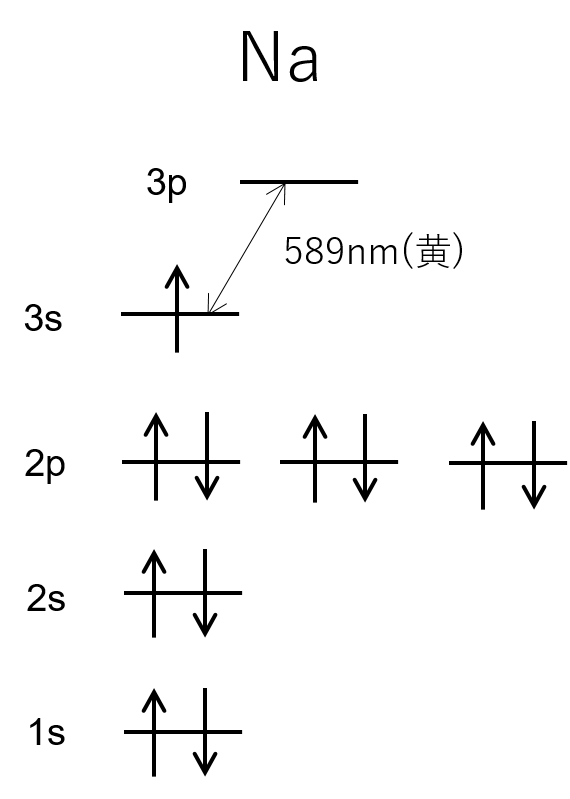
殻と量子数の関係
電子の正しい姿を理解しよう
 ストーク
ストーク
高校化学では、中心に原子核があって、円周状に電子があって・・・
という原子の構造の習い方をするが、現実はそんなに単純ではない。
原子における電子の振る舞いはシュレディンガーの波動方程式を解いて理解しなければならない。
 シママ
シママ
え~?電子って太陽系みたいに原子核を中心として円周状にくるくる回っているんじゃなくて、このsとかpとかdとかいう軌道に沿って存在しているってこと?
 ストーク
ストーク
せやせや。それでな、シュレディンガー方程式を解くと、解が連続じゃなしに飛び飛びの関数になっていることがわかるたい。これすなわち、電子のエネルギーは連続じゃなしに飛び飛びの値をとることを意味しているたい。これを「量子化されている」という。
 シママ
シママ
う~ん・・・。
 ストーク
ストーク
厳密に数学で理解しようとすると難しいけん、こんな風に感覚で理解してはどんな?
①K殻は主量子数1、L殻は2、M殻は3・・・と続く
②方位量子数lは主量子数の数だけ存在できる。(0,1,2,・・・n-1)
③磁気量子数は-l~lだけ存在する。
 シママ
シママ
方位量子数l=0がs軌道で、l=1がp軌道で・・って感じ?
 ストーク
ストーク
せやせや。そうすると1s,2s,2p,3s,3p,3d・・・という順番でエネルギーが高くなっていくことがわかるやろ?
 シママ
シママ
えっと・・・。
 シママ
シママ
ああ、そっか。①と②を考えると、K殻に相当する主量子数1では、l=0しか存在しないから1sしか存在しなくて、
一方で、L殻に相当する主量子数2ではl=0とl=1があるから、2sと2pがあるのか・・・。
主量子数3だとl=0,1,2があるから3s,3p,3dがあって・・・ってことね。
 ストーク
ストーク
せやねん。それで、③を考えるとl=1に相当するp軌道は磁気量子数m=-1,0,1をとる。そうすると2p軌道というのは3種類存在することになる。
 シママ
シママ
うん。
 ストーク
ストーク
以上を踏まえたうえで、もう一回ナトリウムの電子配置図を見てみる。
さっきよりはわかりやすい感じするやろ?

 シママ
シママ
まぁ、そうだけど・・・。上矢印と下矢印はなに?
 ストーク
ストーク
それはスピン量子数いうて、+1/2の値と-1/2の値をとる。
電子の自転の向きを現している。
1s,2s,2p・・・と続くそれぞれの軌道には自転の向きを異とする二つの電子が存在すると考えるとええかな。
 シママ
シママ
1sの軌道に3個以上の電子は存在できないの?
 ストーク
ストーク
お、ええこと気づいたな。存在できんたい。
同じ原子の中に主量子数・方位量子数・磁気量子数・スピン量子数がすべて同じになっている電子2個以上は存在できない。このことをパウリの排他原理という。
せやから、1s軌道に入っている電子は主・方位・磁気量子数がすべて同じで、スピン量子数が+1/2と-1/2の2つの電子しか存在しえないたい。
 シママ
シママ
そのスピン量子数ってのが上矢印と下矢印で表現されているのね・・・。
 ストーク
ストーク
そういうこと。
炎色反応の色を量子化学的に理解する
励起と発光
 ストーク
ストーク
またナトリウムの電子配置図を見てみよう。

 シママ
シママ
電子が3sから3pに移動して、それが元に戻るときに589nmの光、すなわち黄色を発するのね。
 ストーク
ストーク
ああ。3sから3pに移動することを「電子が遷移する」という。特に、エネルギーの高い軌道へ移動することを「電子が励起する」という。
 シママ
シママ
つまり、主量子数3,方位量子数0の軌道から同一主量子数、方位量子数1の軌道に遷移した。
といえるわけね。
 ストーク
ストーク
せやせや・・・せやから、高校化学で習うKLM殻の概念だけではナトリウムの黄色を説明することができんたい。
 シママ
シママ
なるほど・・・。
 シママ
シママ
じゃあ、金属の種類によって色が違うのはなぜ?
 ストーク
ストーク
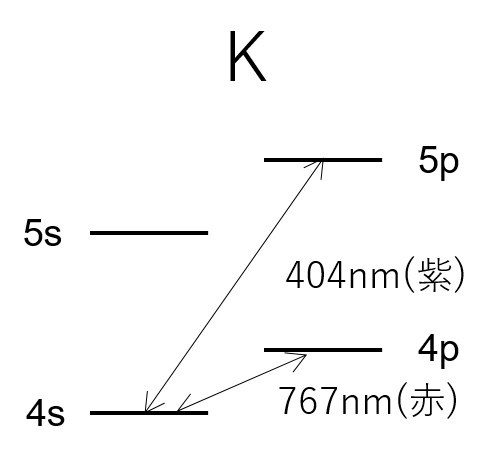
ナトリウムの場合は3sから3pに遷移するわけやが、例えばカリウムなんかは4sから4pへ、4sから5pへという二つの遷移ルートがある。
 ストーク
ストーク
そして、それぞれのエネルギーギャップはギャップの大きさが違うたい。
 シママ
シママ
3s~3pと4s~4pと4s~5pとでは3つとも違うギャップを持っている、というわけね・・・。
 シママ
シママ
あ~!それで4s~4pに由来する赤色と4s~5pに由来する紫色が出るから、カリウムの炎色反応は赤紫色といわれているのね!
 ストーク
ストーク
そういうこと!
 シママ
シママ
それで、金属の種類によってどこからどこへ電子が遷移するのかが違うから
金属の種類によって色々な色をだすのね!
炎色反応と化学分析
発光スペクトルは物質の指紋
 ストーク
ストーク
さっき、ナトリウムの場合は589nmの発光がほとんどやが、多くの金属はいろいろな波長の光を出す。カリウムなんかは2本やったやろ?
光を波長ごとに分解する作業を分光、波長ごとの光の強さ、つまり強度を取得する作業を「スペクトルをとる」というたい。
 シママ
シママ
なんか、化学の専門の人が「スペクトルがどうのこうの」とか言ってたような・・・。
 ストーク
ストーク
ナトリウムの発光スペクトルの例はこんな感じたい。
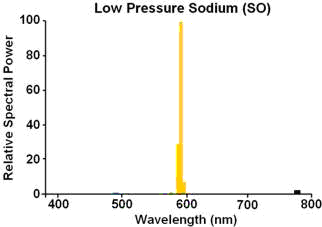
出典:code snippets ナトリウムランプ
 ストーク
ストーク
それで水銀の発光スペクトルの例はこんな感じ。
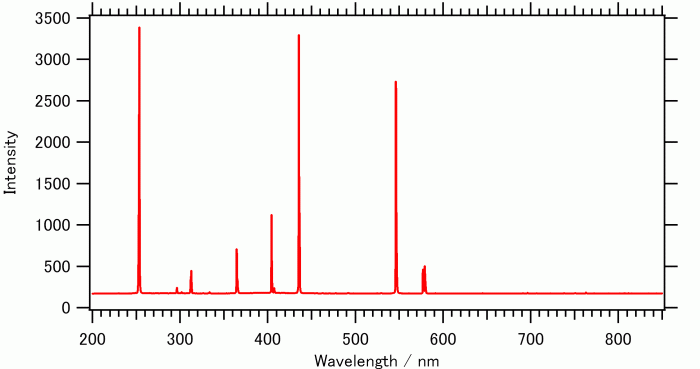
出典:スペクトル色々 ネオンランプと水銀ランプ
 ストーク
ストーク
水銀の方が量子的に許された遷移が多いということやな。基底状態からいろいろな励起状態がとれる。
 ストーク
ストーク
それで、このスペクトルのグラフというのは金属特有やから、金属を含む未知サンプルのスペクトルを取ることでサンプルに含まれている金属の種類がわかるということたいね。
 シママ
シママ
お~すご~い!!探偵みた~い!
 ストーク
ストーク
せやろ?まさかこんな炎色反応が綺麗~すてき~っていう話から、こんな探偵みたいな話になるとは思わんやろ?そういうところが面白いたい。科学って。
 シママ
シママ
うん!
 ストーク
ストーク
それで、実際にこの原理を応用したのがICP発光分光分析法。
ICPってのは、Inductively Coupled Plasmaの略で誘導結合プラズマという。
俺らはエタノールに入れて火を点けただけやが、本格的に化学分析するとなるともっと高温の炎が必要で、このICPってヤツを使えば10000Kの炎を出すことができる。
それでより高感度な分析が可能になる。
 シママ
シママ
あ~よく化学の友達がICPとってくる~!とか言ってたけど、これのことなのか~。
 ストーク
ストーク
10000Kの炎から出る光を回折格子いうもので分光し、それぞれの光の強度を検出してスペクトルとして結果を得るたい。
アルミニウムの炎色反応は?
 ストーク
ストーク
ここで、数ある炎色反応実験のレシピの中には、アルミホイルのカップを利用したものもあったよな。
 シママ
シママ
うん。
 ストーク
ストーク
あの実験、おかしいと思わないか?
 シママ
シママ
おかしいの?
 ストーク
ストーク
いや、やり方としては正しいんやが、一つ疑問を持って、その疑問を解決してから、あの手の実験はやるべきやと思う。
 シママ
シママ
あ・・・なんでアルミニウムの炎色反応はでないんだろう?
 ストーク
ストーク
せや。まさにそれ。実際、アルミニウムの炎色反応は観察されない。
だから、アルミニウムカップに入れて炎色反応を行う実験は成立する。
なぜアルミニウムの炎色反応は観察できないと思う?
 シママ
シママ
アルミニウムは励起と発光が起こりにくい物質だから?
 ストーク
ストーク
ちゃう。そうじゃない。アルミニウムも励起と発光は起こる。ただし、アルミニウムの場合、励起するときのエネルギーギャップがナトリウムやカリウムと比べて大きい。
 シママ
シママ
あ、発光する光が可視光から外れているから!
エネルギーギャップが大きいということは・・・紫外線だから?
 ストーク
ストーク
せや。その通り。
アルミニウムの発光スペクトルはこんな感じ。308~309nmの光って紫外線やろ?
せやから、アルミニウムの炎色反応は起こらないんじゃなしに、観察できない、見ることができないと表現する方が正しいんや。

出典:http://www.elec.chubu.ac.jp/kuzuya-Lab/lma-j.htm
 シママ
シママ
なるほど・・。アルミニウムカップで炎色反応するならそのことを理解したうえでやらないといけないのね・・・。
 ストーク
ストーク
まぁ、少なくとも実験指導者はな。理解しておくべきやと思う。
まとめ
今回は「炎色反応の原理を量子化学の観点から詳しく解説」ということで、小中学校の自由研究課題や理科の授業で出てくる身近な炎色反応という現象を量子化学的観点から詳しく説明しました。
高校化学で学習する電子配置の模型から、主量子数・方位量子数・磁気量子数・スピン量子数の話を踏まえ、大学で学習するより詳細な電子配置図を示し、炎色反応とは電子がエネルギーの低いところから高いところへ遷移し、それが元に戻る際に金属特有の波長の光でもってエネルギーが放出される現象であることをナトリウム、カリウムを例に具体的に説明しました。
そして、金属ごとに放出する光の波長が異なるという事実から、未知試料を燃焼させたときに発生するスペクトルを分析することで、未知試料にどのような金属が含まれているかがわかることを説明しました。このことを応用したICP発光分光法が確立しており、重要な機器分析法の一つになっています。
このように、炎色反応は金属ごとに決まった波長の光を出すことで起きる現象であること、それを応用すれば花火だけでなく、化学分析までできるということを説明しました。








































































 らい・ぶらり
らい・ぶらり

コメントを残す